Fabiola Hernández-Rosas 1, Juan Santiago-García 2 *
1 докторант, Институт за биологични изследвания, Университет Веракрузана по биомедицински науки, Институт за биологични изследвания.
2 Старши изследовател по биологични изследвания, Институт за биологични изследвания, Университет Веракрузана.
* Кореспонденция: Хуан Сантяго-Гарсия
Институт за биологични изследвания, Университет Веракрузана
Електронна поща: [имейл защитен]
Резюме
Циркадните ритми са биологични ритми с продължителност близо 24 часа, те регулират ежедневната ни метаболитна, хормонална и поведенческа активност. Те се установяват чрез присъщата транскрипционна активност на група гени, наречени часовници, които се изразяват ритмично в мозъка и периферните тъкани. Последните епидемиологични проучвания показват, че нарушенията на циркадния ритъм представляват рисков фактор за развитието на рак при хората. Интересното е, че е установено, че мутантните мишки от гена на часовника Per2 развиват тумори. С тези доказателства са анализирани биопсии на различни видове рак при хора, показващи, че експресията на гените Per1, Per2 или Per3 е значително намалена в сравнение с нормалната тъкан. В тази статия правим преглед на доказателствата, които предполагат връзка между промените в циркадните ритми и експресията на часовникови гени с развитието на рак.
Въведение
Животът е ритмично явление. Дейността и функциите на живите същества се проявяват като периодични или ритмични вариации, а не като непрекъснат процес. Тези вариации са известни като биологични ритми. В природата се наблюдават разнообразни биологични ритми; тези с периодичност по-малка от 24 часа се наричат ултрадиански, като: консумация на храна, пулс, почивка и активност и т.н. От своя страна биологичните ритми с периодичност, близка до 24 часа, са известни като циркадни, като: цикъл на сън и събуждане, освобождаване на определени хормони и др. Докато биологичните ритми с периодичност, по-голяма от един ден, се наричат инфрадианни, какъвто е случаят с менструалния цикъл, еструсния цикъл, хибернацията и др.
При бозайниците циркадните ритми се генерират от централен или "главен" биологичен часовник, разположен в хипоталамусните структури, наречени супрахиазматични ядра (SCN) в централната нервна система, и от часовници, разположени в клетки на различни тъкани, известни като осцилатори. Периферни устройства [1, 2]. Заедно тези часовници са системи, способни да генерират времеви ред в дейностите на организма, те трептят с редовен период и използват тези трептения като вътрешна времева справка за регулиране на биологичния ритъм на много от телесните функции, като: сън и събуждане, почивка и активност, телесна температура, кръвно налягане, сърдечен обем, консумация на кислород, баланс на течности и секреция на ендокринната жлеза [1,3]
Гени на часовника и молекулярният механизъм на циркадния часовник
Проучванията за мутагенеза, проведени върху плодовата муха (Drosophila melanogaster), позволиха да се идентифицират мутантни мухи с промени в циркадния ритъм. Характеризирането и анализът на тези мутанти позволи откриването на малък брой гени, участващи в генерирането и поддържането на циркадния ритъм при тези насекоми. Тази група гени се нарича часовник гени или „часовник гени”. Впоследствие хомоложни гени са клонирани при бозайници и са идентифицирани нови гени с часовници от мутантни хамстери или мишки. При бозайници са описани поне девет тактови гена: Per1, Per2, Per3, Cry1, Cry2, Clock, Bmal1, казеин киназа Ie (CkIe) и Rev-Erb_ [1].
Молекулярният механизъм на централния циркаден часовник и периферните циркадни осцилатори включва взаимодействието на положителни и отрицателни сигнали, които регулират ритмичната транскрипция на тактовите гени. Тази група гени е отговорна за контрола на циркадната активност при всички живи същества [1,4]. Експресията на тези гени се регулира с помощта на две транскрипционни вериги за активиране/репресия. Положителният цикъл на сигнала се контролира от гените Clock и Bmal1, докато отрицателният контур се контролира от гените Per и Cry [1,5].
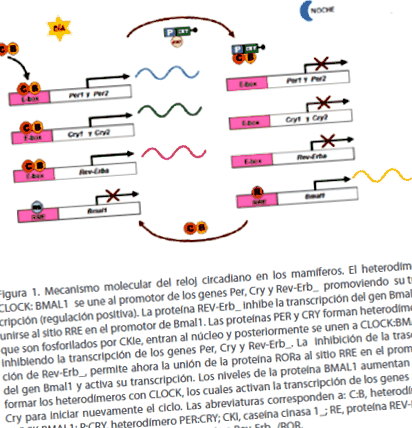
Най-широко приетият модел за обяснение на молекулярния механизъм на циркадния часовник при бозайниците е мишката. Ако поставим функционирането на машината на централния циркаден часовник (NSQ) на мишката в контекста на 24-часов циркаден ден, се получава следното: в началото на циркадния ден (рано сутрин) транскрипцията на Per гени и Cry е активирани от хетеродимерите, които образуват CLOCK: BMAL1 протеини, които се свързват с регулаторни последователности, известни като Е кутии, разположени в промоторите на гените Pery Cry, за да активират тяхната транскрипция. Пратениците на тези гени се превеждат в съответните им протеини (PER и CRY) в цитозола. Към средата на циркадния ден (началото на нощта), PER и CRY протеините се свързват и образуват хетеродимери (PER: CRY), които се фосфорилират от ензима CKI и след това се пренасят в ядрото, където се натрупват. PER: CRY хетеродимери секвестър CLOCK: BMAL1 хетеродимери, пречещи на тяхното свързване към промоторния сайт на гените Per и Cry, инхибирайки тяхната транскрипция. Следователно, PER и CRY протеините действат като отрицателни регулатори [1,5].
ЧАСОВНИКЪТ: BMAL1 хетеродимери също активират транскрипцията на гена, който кодира ядрен рецептор сирак, известен като Rev-Erb_. Попадайки в ядрото, протеинът REV-ERB_ се свързва с промотора на гена Bmal1 и потиска неговата транскрипция, което води до спадане на нивата на mRNA на Bmal1. От друга страна, когато димерите на PER: CRY протеините влизат в ядрото и инхибират транскрипцията на Per и Cry, те също инхибират транскрипцията на Rev-Erb_ и косвено стимулират транскрипцията на гена Bmal1. При липса на REV-ERB_, RORa протеинът (RAR-свързан сирачен рецептор) се свързва с промотора на гена Bmal1 и активира неговата транскрипция. Следователно нивата на протеина BMAL1 се увеличават в края на нощта, благоприятствайки образуването на хетеродимери CLOCK: BMAL1, които активират транскрипцията на гените Per и Cry, за да рестартират цикъла отново (Фигура 1) [1,5].
Фигура 1. Молекулярен механизъм на циркадния часовник при бозайници. ЧАСОВНИКЪТ: BMAL1 хетеродимерът се свързва с промотора на Per, Cry и Rev-Erb_ гените, насърчавайки тяхната транскрипция (положителна регулация). Протеинът REV-Erb_ инхибира транскрипцията на гена Bmal1 чрез свързване към RRE мястото на промотора Bmal1. Протеините PER и CRY образуват хетеродимери, които се фосфорилират от CKIe, влизат в ядрото и впоследствие се свързват с CLOCK: BMAL1, инхибирайки транскрипцията на гените Per, Cry и Rev-Erb_. Инхибирането на транскрипцията Rev-Erb_ сега позволява свързването на RORa протеина с RRE мястото в промотора на гена Bmal1 и активира неговата транскрипция. Нивата на протеина BMAL1 се увеличават, за да образуват хетеродимери с CLOCK, които активират транскрипцията на гените Per и Cry, за да стартират цикъла отново. Съкращенията съответстват на: C: B, CLOCK: BMAL1 хетеродимер; P: CRY, хетеродимер PER: CRY; CKI, казеин киназа 1_; RE, REV-ERB_ протеин; R, RORa протеин; RRE, Елемент за отговор на Rev-Erb_/ROR.
Противоположните ефекти на димерите CLOCK: BMAL1 и PER: CRY в транскрипцията гарантират, че Per и Cry пратениците колебаят в антифаза с Bmal1 пратеника. Максималните и минималните нива в експресията на тези гени се появяват с периодичност близо 24 часа, като по този начин те установяват циркадния ритъм в организмите. Например, в NSQ, максималният пик на експресията на Bmal1 се проявява в средата на нощта, докато максималният пик на пратениците Per и Cry се появява в обяд [1].
Циркадни часовници в периферните тъкани
Циркадни часовници или осцилатори съществуват в голямо разнообразие от периферни тъкани, подобни на тези, които работят в NSQ неврони [14,15,16]. Както NSQ невроните, периферните тъканни клетки, така и култивираните фибробласти показват времеви модели на експресия на генния часовник. Поредица от неотдавнашни проучвания показват, че гените Per, Cry и Bmal1 представят ритмичен израз в различни тъкани като: черен дроб, сърце, бял дроб, бъбреци, култивирани фибробласти и други [1,2,15,16]. Въпреки това, за разлика от NSQ, циркадните трептения в експресията на часовникови гени в периферните тъкани на бозайници бързо намаляват, когато се поддържат като експланти в културата. В периферните тъкани на плъхове циркадната експресия на тактовите гени се губи в рамките на 2 до 7 дни, докато в култивираните фибробласти след 3 до 4 цикъла [15,17]. За разлика от тях, циркадната експресия на часовникови гени в култивиран NSQ се поддържа за повече от един месец [17,18]. Това доведе до постулацията, че NSQ е главният или централен часовник с присъщ циркаден ритъм, който чрез различни невронни и хуморални сигнали синхронизира активността на циркадни осцилатори, разположени в периферните тъкани и други мозъчни области.
От друга страна, доказано е, че различни сигнали, като прилагането на глюкокортикоидни аналози и промяната в схемата на хранене, променят циркадните модели на експресия на генни часовници в черния дроб и други периферни тъкани, но не влияят върху тяхната експресия в NSQ [15-17, 19, 20]. Това предполага, че при определени метаболитни или физиологични условия, локалният контрол на ритъма на периферните осцилатори може да бъде отделен от контрола на NSQ, за да се адаптира към определени условия, без да влияе на централния часовник. Това от своя страна би позволило оптимизирането на клетъчната физиология по такъв начин, че експресията на определени гени да бъде ограничена, когато се изискват техните продукти. Когато тези специфични условия изчезнат, NSQ може да синхронизира периферните осцилатори обратно към техния нормален ритъм [2,16,17,19].
Гени на часовника и рак
За да се разбере функцията на всеки от тактовите гени в молекулярния механизъм, отговорен за генерирането на циркадни ритми, са разработени серия от мутантни или нокаутирани мишки, при които функцията на тези гени. Тези мутантни мишки показват загуба на циркадния ритъм на двигателна активност и поглъщане на вода. Изненадващо откритие се случи при разработването на мутантни мишки от гена на часовника Per2, които освен загуба на циркаден ритъм, развиха хиперплазии на слюнчените жлези, лимфоми и кожни тератоми [13]. Чрез лечение на мутантни мишки Per2 с гама лъчение, агент, който уврежда ДНК, развитието на тумора се ускорява, предизвиквайки преждевременна смърт при тези гризачи. За разлика от това, този фенотип не се наблюдава при контролни (немутантни) мишки, подложени на същото третиране [13].
Въз основа на тези наблюдения, различни изследователски групи по целия свят са се заели със задачата да характеризират експресията на часовникови гени в биопсии на различни видове рак при хората. В тези проучвания е установено намаляване на експресията на тактови гени, по-специално на гените Per1 и Per2, при рак на гърдата [21,22], рак на белия дроб [24], рак на ендометриума [25], рак на простатата [ 26], рак на панкреаса [27], наред с други (маса 1).
маса 1. Експресия на гените Per при различни видове рак
За да се опитат да обяснят намаляването на експресията на гени Per в биопсии на рак, са анализирани моделите на метилиране на тези гени, тъй като е известно, че прометиращото метилиране в CpG последователности представлява епигенетичен механизъм, който регулира генната експресия. В този смисъл беше установено, че CpG сайтовете в hPer1 генния промотор са метилирани в повече от 50% от случаите на рак на гърдата, което обяснява намаляването на нивата на тяхната експресия [22]. Подобно проучване при пациенти с хронична миелоидна левкемия разкрива, че метилирането на промоторното място на hPer1, hPer2 и hPer3 гените корелира директно с намаляването на експресията на тези гени [23,28]. Тези данни показват, че експресията на гените Per се контролира отчасти чрез епигенетични механизми.
Гените Per1 и Per2 също са туморни супресори
Клетъчното разпространение е съществен процес за формирането, възстановяването и поддържането на правилното функциониране на всички тъкани и органи в тялото. Гените, известни като туморни супресори, са отговорни за организирането на процесите, свързани с контрола на клетъчната пролиферация и смърт в организма. Тези гени действат като отрицателни регулатори на клетъчната пролиферация, когато не присъстват или са неактивни поради мутации, те пречат на клетката да се размножава нормално, придобивайки пролиферативни свойства, характерни за туморните клетки.
Таблица 2. Ефект на промени в експресията на гените Per1 и Per2 в раковите клетъчни линии
Фигура 2. Гените Per1 и Per2 участват в контролни точки, които спират клетъчната пролиферация. Схемата показва различни точки, за които са натрупани експериментални доказателства за възможното участие на гените Per в контрола на клетъчния цикъл. Съкращенията съответстват на: Cdk, циклин-зависима киназа; ATM, Ataxia Telangiectasia мутирала киназа; ATR, ATR свързана с протеин киназа; Chk1, Checkpoint киназа 1; Chk2, Checkpoint киназа 2; Gadd45a протеин 45 алфа за индукция на растеж, откриване и увреждане на ДНК; Cdc25, цикъл на клетъчно делене фосфатаза 25.
Други скорошни данни, получени от Gery et al (2006), показват, че Per1 взаимодейства с ATM и Chk2 кинази, които участват в механизмите за реакция на увреждане на ДНК [24]. Тези кинази оказват голямо влияние върху няколко от пунктовете за клетъчен цикъл и върху реакцията срещу агентите, увреждащи ДНК. Когато ATM киназата открива увреждане на ДНК, тя реагира чрез увеличаване на своята биохимична активност, която модифицира други протеини, всеки от които е отговорен за определен отговор при възстановяване на увреждане на ДНК, блокиране на клетъчния цикъл и предизвикване на апоптоза.
Патологии, свързани с нарушения на циркадния ритъм Човешкото същество представя серия от физиологични промени по време на циркадния ден (24 часа). Например, хормоналните промени, които настъпват в началото на деня, главно на нивото на оста хипоталамус-хипофиза-надбъбречна жлеза, водят до освобождаване на катехоламини в кръвта със съответния им активиращ ефект върху органичните функции. Това прави възможно тялото да остане будно и активно поради повишаване на мускулния тонус и нервната активност. Освобождаването на катехоламини намалява през нощта, което също намалява неговия активиращ ефект и настъпва сън, период, в който съзнателните интелектуални функции се отменят, за да отстъпят място на несъзнаващите. Следователно целостта на циркадната биологична структура е от решаващо значение за ефективното биологично и когнитивно функциониране.
Перспективи за раковата хронобиология и хронотерапия
Заключения
Показано е, че промените в циркадния ритъм са рисков фактор за развитието на различни патологии, включително рак, което предполага, че целостта на циркадния ритъм е важен аспект за здравето. Също така е установено, че дефектите в експресията на някои тактови гени, като гените Per, водят до недостатъци в контрола на клетъчния цикъл и в отговор на увреждане на ДНК, както и в развитието на тумори при гризачи . С други думи, циркадният часовник не само организира различни биологични и поведенчески процеси, но също така играе основна роля в клетъчната физиология. Необходими са обаче още изследвания, за да се изясни ролята на циркадния часовник в клетъчната пролиферация, апоптоза и механизмите на злокачествената трансформация. Тези изследвания ще бъдат от голямо значение, тъй като ще позволят да се генерират ценни знания за разработването на нови терапевтични възможности срещу рак.
Благодаря
До Националния съвет за наука и технологии (CONACYT), за стипендията, отпусната на Fabiola Hernández-Rosas (член №: 223273) и на PROMEPSEP за финансирането, предоставено на Juan Santiago-García (PTC-270).
- Бързо отслабване на Valley Medical; Достъпни медицински програми за отслабване
- Т; циничен контролен възел в хирургията; a от c; кърмене в болница без
- Стоманен часовник Rond Touch часовник
- Какъв тип тяло имате? Ябълка, круша или пясъчен часовник Нов дневник
- Swimmo - пулсомер и часовник за плуване, брояч за дължина, часовник за басейн • Swimmo