The горещо (представено с буквата Q) е прехвърлена енергия от една система в друга (или от една система към околната среда) обикновено поради разликата в температурата между тях. Топлината, погълната или отделена от термодинамична система, обикновено зависи от вида на трансформацията, която системата е претърпяла.
Две или повече тела в контакт, които са с различни температури, след известно време достигат топлинното равновесие (една и съща температура). Този факт е известен като Нулев принцип на термодинамиката, и е илюстрирано на следващата фигура.
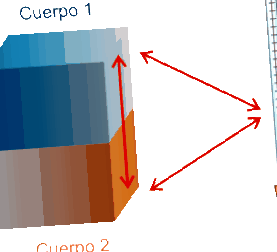 |
Един аспект на топлината, който трябва да се подчертае, е този телата не съхраняват топлина но вътрешна енергия. Следователно топлината е пренос на част от споменатата вътрешна енергия от една система в друга, при условие, че и двете са при различни температури. Неговите единици в Международната система са джаули (J)
Изразът, който свързва количеството топлина, което маса m от дадено вещество обменя с промяната в температурата Δt, което изпитва, е:
където c е специфична топлина на веществото.
Специфичната топлина (или специфичен топлинен капацитет) е енергията, необходима за повишаване на температурата от 1 кг маса с 1 градус. Неговите единици в Международната система са J/kg K.
Като цяло специфичната топлина на дадено вещество зависи от температурата. Тъй като обаче тази зависимост не е много голяма, тя обикновено се третира като константа. Тази таблица показва специфичната топлина на различните елементи на периодичната таблица и тази таблица показва специфичната топлина на различните вещества.
Когато се работи с газове, доста често се изразява количеството вещество чрез броя на бенките n. В този случай се нарича специфичната топлина моларен топлинен капацитет В. Топлинният обмен след това се дава от:
В Международната система единиците на моларния топлинен капацитет са J/molK.
- Критерий за знаци: В тези страници топлината, погълната от тялото, ще бъде положителна, а отделената топлина отрицателна.
Топлинна мощност на идеален газ
За идеален газ се дефинират два моларни топлинни капацитета: a постоянен обем (CV) и постоянен натиск (Cp).
- CV: е количеството топлина, което е необходимо за подаване на мол идеален газ, за да се повиши температурата му с една степен чрез изокорална трансформация.
- Cp: е количеството топлина, което е необходимо за подаване на мол идеален газ, за да се повиши температурата му с един градус чрез изобарна трансформация.
Стойността на двата топлинни капацитета може да се определи с помощта на кинетичната теория на идеалните газове. Съответните стойности за монатумни и двуатомни газове се намират в следната таблица:
където R е универсалната идеална газова константа, R = 8,31 J/mol K.
Латентна топлина на фазова промяна
Когато промяна на фазата, веществото трябва да поеме или да се откаже от определено количество топлина, за да се осъществи. Тази топлина ще бъде положителна (погълната), когато настъпи промяната на фазата отляво надясно на фигурата, и отрицателна (отстъпваща), когато настъпи фазовият преход отдясно наляво.
Топлината, погълната или пренесена при фазова промяна, не се превръща в промяна в температурата, тъй като енергията, доставяна или извлечена от веществото, се използва за промяна на агрегатното състояние на веществото. Тази топлина се нарича латентна топлина.
Латентно на латински означава скрит и се нарича така, тъй като, тъй като температурата не се е променила по време на смяната на състоянието, въпреки добавянето на топлина, тя остава скрита, без да се превръща в промяна в температурата.
Латентна топлина (L) или топлина на промяна на състоянието е енергията, погълната или пренесена за единица маса вещество при промяна на състоянието. От твърдо до течно тяло се нарича топлина скрито сливане, от течност до пара латентна топлина на изпаряване и от твърдо на пара латентна топлина на сублимация.
Латентната топлина за обратните процеси (представена в синьо на предишната фигура) имат същата стойност в абсолютна стойност, но те ще бъдат отрицателни, тъй като в този случай това е пренесена топлина.
В международната система латентната топлина се измерва в J/kg.
Количеството топлина, абсорбирано или отделено от количество m вещество за промяна на фазата, се определя от:
Тази топлина ще бъде положителна или отрицателна в зависимост от настъпилата фазова промяна.
Страница направена от Тереза Мартн Блас и Ана Серано Фернденд - Политехнически университет в Мадрид (UPM) - Испания.
- Първи принцип на термодинамиката
- Половин век от първото излизане в космоса Ел Диарио Васко
- Латвийският клубен баскетбол не трябва да се подценява! Янис Гайлитис очаква първото дерби на
- За хронично лечение на наднормено тегло и затлъстяване, Novo Nordisk стартира първо инжекционно лечение
- Зъболекарите съветват редовни орални прегледи при деца след първия зъб да
