- Субекти
- Обобщение
- Въведение
- Резултати
- Рационален дизайн на нов лиганд за структурни изследвания.
- Обща архитектура на многодоменния човешки SMO
- Уникално многодоменно взаимодействие
- Сравнение на човешки SMO с други рецептори от клас на къдрене
- Дискусия
- Методи
- Синтез на TC114
- Конструкция на термоядрен синтез SMO-FLA, предназначена за структурни изследвания
- Експресия и пречистване на сливания протеин SMO-FLA
- Кристализация в LCP за събиране на синхротронни данни
- Събиране на синхротронни данни и определяне на структурата
- Кристализация в LCP за събиране на данни XFEL
- Събиране на данни от XFEL и определяне на структурата
- Анализ на мас-спектрометрия за обмен на водород-дейтерий
- MD симулация
- Приготвяне на протеини и изграждане на системата.
- Молекулярна динамична симулация и анализ на данни.
- Тест за сигнализация на таралеж
- Анализ на Western Blot
- Наличност на данни
- Допълнителна информация
- PDF файлове
- Допълнителна информация
- Файл за партньорска проверка
- Коментари
Субекти
- Биология на развитието
- Нанокристалография
Обобщение
Изгладеният рецептор (SMO) принадлежи към клас Frizzled на суперсемейството на G-протеин-свързан рецептор (GPCR), съставлявайки ключов компонент на сигналния път на таралежа. Тук представяме кристалната структура на многодоменен човешки SMO, свързан и стабилизиран от инструмент, проектиран от лиганд TC114, използващ източник на рентгенов лъч без електронни лъчи 2,9 Å. Структурата разкрива прецизно подреждане на три различни домена: седем трансмембранен спирален домен (TMD), шарнирен домен (HD) и непокътнат богат на извънклетъчен цистеин домен (CRD). Тази архитектура позволява алостерични взаимодействия между домейните, които са важни за разпознаването на лиганда и активирането на рецептора. Чрез комбиниране на структурни данни, симулация на молекулярна динамика и анализ на обмен на водород-дейтерий, ние демонстрираме, че трансмембранната спирала VI, извънклетъчната верига 3 и HD играят централна роля в предаването на сигнала с помощта на механизъм за активиране. GPCR.
Въведение
Резултати
Рационален дизайн на нов лиганд за структурни изследвания.
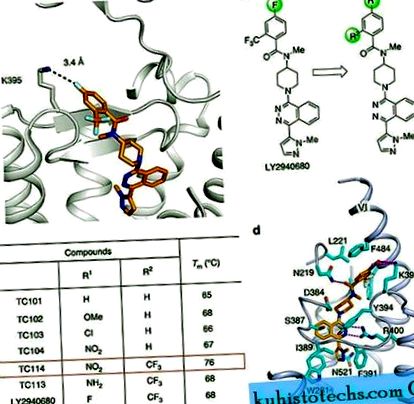
Пресеченият SMD на CRD (ΔCRD-SMO) преди това е съкристализиран с няколко малки молекули, включително антагонисти и агонисти 3, 8, 9. Тези лиганди и други не произвеждат кристали на мултидомен SMO, които съдържат непокътната CRD без стабилизиращи мутации. Анализът на по-ранни структури на ΔCRD-SMO 3, 8, 9 предполага, че кристализацията на мултидомен SMO може да изисква стабилизиране на някои специфични гъвкави части на структурата. Например установихме, че K395, разположен в горната част на β фиби в извънклетъчната верига 2, може да участва във взаимодействия със съседни остатъци или лиганди 3 и следователно вероятно приема динамично конформационно състояние (фиг. 1а). Следователно, ние предполагаме, че по-нататъшното стабилизиране на този регион чрез установяване на определено и по-силно взаимодействие може да намали конформационната хетерогенност.
( да се ) Изглед отблизо на джоба за подвързване LY2940680 в структура ΔCRD - SMO (PBD ID: 4JKV). ( б ) Проектиране и развитие на аналози LY2940680 за изследване на кристализацията чрез вариация на заместителите на ароматния пръстен. ( ° С ) Представителни стойности на Tm за LY2940680 и неговите аналози съгласно теста за топлообмен CPM. ( д ) Изглед отблизо на джоба за подвързване TC114. TC114 (оранжеви въглероди) и SMO остатъци (цианови въглеродни атоми), участващи в свързването на лиганда, са показани в лентово представяне. Приемникът е показан в светлосиньо анимационно изображение. Други елементи са оцветени, както следва: кислород, червено; азот, тъмно синьо; сяра, жълто. Водородните връзки са показани като пунктирани пурпурни линии.
Изображение в пълен размер
Анализът на нашите многодоменни SMO структури показва, че нитро групата, въведена в лиганда TC114, силно взаимодейства с K395 в SMO, както е проектирано, и подобрява подреждането π - π между бензоилната група и F484 в спирала VI (фиг. 1г). Следователно заключаваме, че TC114 стабилизира мултидомен SMO, като поддържа VI спиралата в стабилна конформация, което от своя страна засилва хидрофобното взаимодействие между разширения ECL3 и хидрофобния CRD жлеб. Следователно, проектираният лиганд TC114 постигна желаната цел, действайки като супер стабилизиращ агент в теста за термична стабилност и позволявайки изследването на мултидомен SMO кокристализация.
Обща архитектура на многодоменния човешки SMO
Общата структура на SMO (фиг. 2а; допълнителна фиг. 4) споделя GPCR 7 ™ канонична гънка с амфипатична спирала VIII, която минава успоредно на равнината на мембраната. CRD седи изправен върху TMD и се поддържа от извънклетъчен контур 3 (ECL3) от едната страна и от свързващ контур (остатъци 181–190) от другата. CRD и TMD са свързани чрез HD (остатъци 191–220). Освен това, от извънклетъчната страна на конструкцията (фиг. 2б), спиралата VI се простира отвъд повърхността на мембраната в четири α-спирални завои, а върхът на спиралата VI се спуска в непролинен завой към CRD, изпъквайки в неговата хидрофобна бразда и свързване на ключова връзка между CRD и TMD. CRD (остатъци V107, L108, L112), HD (остатък V210) и ECL3 (остатъци V494, I496) образуват хидрофобен джоб (фиг. 2в). По-рано беше съобщено, че този джоб представлява място за свързване на оксистерол 7, 19 .
( да се ) Глобална структура на човешки SMO в комплекс с TC114, определена в XFEL. TC114 е показан като оранжеви пръчици. CRD, Linker, HD и TMD са посочени като карикатура съответно оранжево, морско, цианово зелено и светло синьо. Границата на мембраната е обозначена като оранжева пунктирана линия. N-свързаните гликани (NAGs) са показани в зелени ленти. ( б ) Изглед отгоре на SMO от извънклетъчната страна. Хидрофобният джоб се формира от хидрофобния CRD жлеб и ECL3 (морска дръжка). ( ° С ) Ключовите остатъци в CRD и ECL3, които определят хидрофобния джоб, са показани съответно в циан и светлосини ленти, съответно.
Изображение в пълен размер
Уникално многодоменно взаимодействие
Изображение в пълен размер
Сравнение на човешки SMO с други рецептори от клас на къдрене
( да се ) Страничен изглед на структури, насложени върху човешки CRD SMO (hSMO) с CRD hFzd-4 (PDB ID: 5CL1) и mFzd-8 (PDB ID: 4F0A). SMO, hFzd-4 и mFzd-8 са показани като карикатури, съответно в светло синьо, лимонено зелено и оранжево. Wnt и Norrin са показани съответно като тъмносиви и оранжево-жълти карикатури. Палмитоиловата група в mFzd-8 CRD е показана в морски сфери. ( б ) Място 1: Изглед отблизо на палмитоиловата група с взаимодействащи остатъци като портокалови пръчици. Палмитоиловата група е показана в морски пръчки. Остатъците от SMO, които съставляват хидрофобния джоб, са показани в светлосини ленти, mFzd-8 в оранжеви ленти. ( ° С ) Обект 2: Повърхност на SMO и hFzd-4 CRD. Норин е показан в светлооранжев анимационен филм. Цветовият градиент от светлочервен до тъмночервен съответства на промяната на свойствата на повърхността от хидрофилна към хидрофобна. Мястото за свързване на Norrin на повърхността на hFzd-4 CRD е маркирано с черен пунктиран кръг със съответното място, маркирано също на SMO повърхността.
Изображение в пълен размер
Дискусия
Методи
Синтез на TC114
Разтвор на 4-нитро-2- (трифлуорометил) бензоена киселина (80 mg, 0,34 mmol), вторичен амин N-метил-1- (4- (1-метил-1Н-пиразол-5-ил) фталазин-1- ил) пиперидин-4-амин (100 mg, 0,31 mmol) и N, N-диизопропилетиламин (DIPEA, 60 mg, 80 μl, 0,46 mmol) в 3 ml CH2Cl2 се третират с 1- [бис (диметиламино)) метилен] -1Н-1,2,3-триазоло [4,5-Ь] пиридиниев хексафлуорофосфат на 3-оксиди (HATU, 153 mg, 0,40 mmol). Реакционната смес се разбърква при стайна температура в продължение на 1 час, преди да бъде загасена чрез добавяне на солев разтвор. Реакционната смес се екстрахира три пъти с СН2С12. Комбинираният органичен слой се промива последователно с наситен разтвор на NaHC03 и солев разтвор, след което се суши над Na2S04. След филтриране, разтворът се концентрира под вакуум и суровият продукт се пречиства чрез флаш колонна хроматография върху силикагел до получаване на TC114, като безцветно твърдо вещество (82 mg, 49%). Ядрено-магнитен резонанс показа смес от ротамери.
Конструкция на термоядрен синтез SMO-FLA, предназначена за структурни изследвания
Човешкият див тип (WT) SMO ген е синтезиран от Genescript и след това е клониран в модифициран pTT5 вектор, съдържащ експресионна касета с HA сигнална последователност, последвана от FLAG маркер, 10 × His маркер и вирус на тютюневия ец TEV)) място за разпознаване на протеаза в N края преди рецепторната последователност и още 10x His маркер в края C. Малък протеин Flavodoxin (FLA, MW 16KD) 16 се слива с ICL3 между P434 и S443, като се използва слоеста PCR. N терминалът 1–52 и C терминалът 559–787 бяха пресечени. Една мутация E194M беше въведена в HD за изграждане, чиито кристали бяха използвани за събиране на данни в XFEL. Конструкцията, използвана за определяне на синхротронната структура, не съдържа точкова мутация и е леко модифицирана чрез допълнително отрязване на N-края на пет остатъка. Всички последователности от праймери, използвани в това проучване, са показани в допълнителната таблица 1.
Експресия и пречистване на сливания протеин SMO-FLA
Кристализация в LCP за събиране на синхротронни данни
Пробите от SMO рецепторни протеини в комплекс с TC114 бяха възстановени в липидна кубична фаза (LCP) чрез смесване с разтопени липиди (10% (w/w) холестерол, 90% (w/w) моноолеин) в съотношение 2/протеин разтвор 3 (v/v)/липиди с помощта на механичен смесител за спринцовки 29. Анализите за LCP кристализация се провеждат с използване на NT8-LCP кристализационен робот (Formulatrix) в 96-кладенчеви стъклени сандвич плочи (Nova). След настройката плочите се инкубират и се изобразяват при 20 ° С с помощта на автоматизирана камера за изображения/инкубатор (RockImager 1000, Formulatrix). Първоначалните находки от кристали бяха открити в утаяващо състояние, съдържащо 100 mM натриев цитрат три основен дихидрат, рН 5,0, 30% (v/v) PEG400, 100 mM амониев нитрат. След оптимизация кристалите нарастват в 100 mM тринадесен дихидрат натриев цитрат рН 5,0, 36% (v/v) PEG400, 50–200 mM амониев нитрат до средния размер 47 × 23 × 8 μm 3 в рамките на 7 дни. SMO кристалите се събират директно от LCP, като се използват 30 μm микромонта (MiTeGen) и се замразяват в течен азот за събиране на данни.
Събиране на синхротронни данни и определяне на структурата
Таблица в пълен размер
Кристализация в LCP за събиране на данни XFEL
Кристали за LCP-XFEL се получават в газонепроницаеми спринцовки Hamilton, както е описано по-горе 38, чрез инжектиране на ∼5 μl натоварен с протеин LCP като непрекъсната колона с диаметър ∼ 400 μm в спринцовка от 100 μl, пълна с 60 μl разтвор за утаяване, съдържащ 100 mM натриев цитрат триосновен дихидрат, рН 5,0, 36% (v/v) PEG400, 150 mM амониев хлорид и се инкубира в продължение на най-малко 24 часа при 20 ° C. След образуването на кристалите (размер 5 × 5 × 2 μm 3 среда ), пробите от 2 до 3 спринцовки бяха консолидирани заедно и излишният утаяващ разтвор беше отстранен. Остатъчният утаяващ разтвор се абсорбира чрез добавяне на няколко микролитра стопен MAG 7,9 липид 39. Получената кристална LCP проба се проверява под визуален микроскоп и се зарежда върху инжектор LCP 9 за събиране на данни от LCP-SFX.
Събиране на данни от XFEL и определяне на структурата
Анализ на мас-спектрометрия за обмен на водород-дейтерий
MD симулация
Приготвяне на протеини и изграждане на системата.
Кристалната структура на холестерол SMO рецептора е получена от базата данни PDB (PDB код: 5L7D 20). За изграждане на модела е избрана верига А на структурата. Prime 45 е използван в изданието на Schrödinger 2015-3 и ICL3 е изграден по хомологичен модел, използвайки друга кристална структура от Smo (PDB код: 4JKV (реф. 3)), и Prime прогнозира ICL2 веригата. Моделът е усъвършенстван от Prepwizard 46 при рН 7,0 и C или N терминалът е ограничен от ACT и NME.
Мембраната около трансмембранния домейн на SMO рецептора е конструирана от 135 POPC молекули и 48 холестерола, използвайки уеб сървъра CHARMM-GUI 47. Кутията на крайната периодична лимитна система е 84,75 × 84,75 × 139,85 Å, а за разтваряне и неутрализиране на кутията са използвани 20881 води TIP3P и 62 Na + и 68 Cl - йони (0,15 mol l −1 NaCl). Системата имаше общо 93 475 атома на периодична клетка.
Молекулярна динамична симулация и анализ на данни.
Представената сила 48 на Amber99sb-ILDN беше приложена към SMO рецептора, вода и йони TIP3P, а силовото поле Slipids 49 беше приложена към холестерола и POPC. За симулацията е използван Gromacs 5.1.2 (справка 50), а протоколът за релаксация е получен от CHARMM-GUI и описан в хартия и уеб сървър. Първо, системата е сведена до минимум от 10 000 стъпки по процедурата за най-стръмно спускане и е уравновесена при постоянна температура (303,15 K) и постоянно налягане (1,0 бара) при 50 ps NVT и 125 ps NPT условия със силни ограничения върху протеините и липидите и несвързан гранична граница от 10–12 Å. Впоследствие се извършва равновесие от 2 ns NPT в същото състояние със слаби протеинови и липидни ограничения, за да се получи балансираната фаза. Накрая бяха проведени две идентични MD симулации на продукта от 1000 ns в SMO рецептора и холестерола като лиганд в липидната и водната система.
Резултатът от MD симулацията на продукта е анализиран от Gromacs 5.1.2. Ъгълът, дефиниран от три атома (C-alpha на P69, V210 и W535), е избран, за да опише наклона на SMO CRD спрямо SMO TMD.
Тест за сигнализация на таралеж
Клетките Light II (ATCC; Rockville, MD) със стабилна ектопична експресия на 8 х луцифераза на светулка светулка в мястото на свързване на Gli и конститутивни репортерни конструкции Renilla луцифераза са засяти в 96-ямкови плаки. След трансфекция с изгладени или различни гладки мутантни плазмиди от див тип, както е посочено, клетките са подложени на различни обработки, както е посочено в продължение на 36 часа. Активността на луциферазата в светлинни II клетки беше измерена с помощта на Promega Dual Luciferase Assay System Kit (съгласно инструкциите на производителя на луминометър (Molecular Devices; Sunnyvale, CA)) (Madison, WI) и тя беше нормализирана до стойностите на Renilla. Данните бяха начертани и IC50 стойностите бяха определени с помощта на GraphPad Prism. Всяка точка от данни представлява средната стойност ± sd, повторена в три екземпляра.
Анализ на Western Blot
Клетките след различни трансфекции, както е посочено, бяха събрани и подложени на лизисен буфер (50 mM Tris, pH 7,4, 150 mM NaCl, 1% NP-40, 1 mM натриев ванадат, 1 mM PMSF, DTT 1 mM, 10 mg ml -1 левпептин и апротинин), последвано от имуноблот анализ. Първичните антитела срещу SMO и GAPDH (Santa Cruz Biotechnology, Santa Cruz, CA, USA) бяха използвани за имуноблот анализ съгласно рутинна процедура 51. Антителата срещу SMO и GAPDH се разреждат съответно 1: 200 и 1: 5000, съгласно инструкциите на производителя.
Наличност на данни
Координатите и структурните фактори са депозирани в Протеиновата банка данни за SMO-TC114, решен в XFEL (PDB: 5V56) и синхротрон (PDB: 5V57). В това проучване са използвани PDB кодовете за достъп 4JKV, 5L7D, 5L7I, 4QIM, 4QIN, 4N4W, 4O9R, 5KZZ, 5KZV, 5KZY, 5CL1, 4F0A. В това проучване са използвани кодове за достъп UniProt Q99835 за човешки SMO. Всички други данни се предоставят от съответните автори при разумна заявка.
Допълнителна информация
PDF файлове
Допълнителна информация
Допълнителни фигури, допълваща таблица, допълващи методи и допълнителни препратки.
Файл за партньорска проверка
Коментари
Изпращайки коментар, вие се съгласявате да спазвате нашите Общи условия и насоки. Ако откриете нещо злоупотребяващо или което не отговаря на нашите условия или насоки, моля, маркирайте го като неподходящо.
- Фамагуста възобновява своя контролиран от Турция курорт въпреки съпротивата на Кипър
- Комплект за изгаряне на мазнини Herbesan Bio Guarana 20 ампули от 15 мл
- Herbalife пусна Мултивитаминен комплекс с 22 основни витамини и минерали - Новини
- Формула 2 Витаминно-минерален комплекс - Това е уебсайтът на член на Herbalife
- Инжекционен HGH човешки растежен хормон за Melanotan 2 Прясно сухо съхранение