- Субекти
- Обобщение
- Въведение
- Резултати
- Диференциална експресия на чернодробни miRNAs при мишки с фиброзиращ стеатохепатит
- Базиран на микрочипове анализ на генна онтология и анализ на пътя за диференциално експресирани miRNAs
- Валидиране на експресията на miRNA чрез количествена PCR в реално време (qRT-PCR)
- miR-146a-5p беше регулиран надолу в активирани HSC инвитро
- Свръхекспресията на MiR-146a-5p потиска пролиферацията на HSC
- Ефекти на miR-146a-4p върху активирането на HSC и отлагането на колаген
- miR-146a-5p действа директно върху 3'UTR на иРНК на Wnt1 и Wnt5a
- miR-146a-5p регулират отрицателно Wnt1 и Wnt5a на ниво след транскрипция
- Ефекти от свръхекспресията и инхибирането на miR-146a-5p върху целевите гени надолу по веригата на сигналния път Wnt
- Нокдаунът на Wnt1 или Wnt5a инхибира генните експресии на сигнализация и фиброгенеза след Wnt
- Дискусия
- Методи
- Животински модели на безалкохолен фиброзиращ стеатохепатит
- Хистологичен анализ и биохимичен анализ.
- Анализ на MicroRNA Microarray
- QRT-PCR анализ
- Идентифициране на потенциални миРНК цели
- Изолация, култура и идентификация на HSC
- Трансфекция на MiR-146a-5p в HSC
- РНК интерференция и трансфекция
- Имуноцитохимичен анализ.
- Анализ на клетъчна пролиферация
- Анализ на Western Blot
- Анализ на активността на луциферазата
- статистически анализ
- Допълнителна информация
- Допълнителна информация
- PDF файлове
- Допълнителна информация
- Коментари
Субекти
- Чернодробна фиброза
- Безалкохолна мастна чернодробна болест
Обобщение
Въведение
Безалкохолният стеатохепатит (NASH) е част от спектъра на неалкохолната мастна чернодробна болест (NAFLD), характеризиращ се със стеатоза, лобуларно възпаление и прогресивна перицелуларна фиброза. При продължително чернодробно увреждане стеатохепатитът може да прогресира до чернодробна фиброза, характеризираща се с прекомерно натрупване на извънклетъчен матрикс (ECM). Чернодробните звездни клетки (HSC) играят централна роля в патогенезата на чернодробната фиброза 2. Неактивните HSC могат да се активират в отговор на хроничен стеатохепатит 3. Активираните HSC стимулират производството на колаген и натрупването на ECM, което води до появата на чернодробна фиброза 4. Въпреки фундаменталния напредък в разбирането на патофизиологията на фиброзиращия неалкохолен стеатохепатит, механизмите на фиброгенезата в присъствието на стеатохепатит остават неуловими.
Резултати
Диференциална експресия на чернодробни miRNAs при мишки с фиброзиращ стеатохепатит
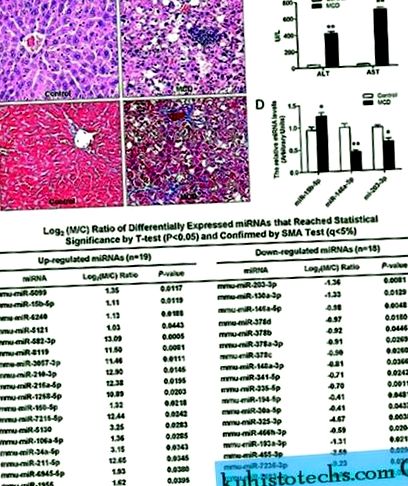
Както е показано на фиг. 1, чернодробни участъци от мишки, хранени с MCD диета, показват нарушена лобуларна структура, макростеатоза в зона 3, точкова или фокална некроза на хепатоцити, възпалителна инфилтрация и перисинусоидална фиброза (фиг. 1А), която е придружена от значително по-висок серум Нива на ALT и AST (P 2 пъти) (Фиг. 1C).
( ДА СЕ ) Хистопатологични промени на чернодробни секции при мишки, хранени с диета и контрол на MCD. Оцветени с хематоксилин и еозин (отгоре) и трихроматизъм на Masson (отдолу). ( Б. ) Ефект на MCD диетата върху серумните нива на ALT и AST. ( ° С ) Диференциално регулирани miRNAs, идентифицирани чрез miRNA микрочипове. ( д ) Проверка на данните от микрочипове с помощта на RT-PCR в реално време. Тестовете бяха проведени в три екземпляра за всяка РНК проба и относителното количество на всяка miRNA беше нормализирано до U6 snRNA. Стойностите са средни ± SD, ** P
( ДА СЕ ) Анализ на GO категория, базиран на прогнозирани цели на всички диференцирано регулирани miRNAs. Вертикалната ос представлява категорията GO, а хоризонталната ос представлява обогатяването на GO. ( Б. ) Анализ на пътя за диференциално регулирани miRNAs. Показват се само маршрути с P
( ДА СЕ ) Представителни морфологични изображения и имуноцитохимично оцветяване на неподвижни и активирани HSC за десмин и α-SMA (400 ×). ( Б. ) експресията на miR-146a-5p беше изследвана чрез qRT-PCR в реално време. Стойностите са средни ± SD, ** P # P
( ДА СЕ ) Оцветяването с Desmin, показващо пролиферация на клетки LX-2 и HSC-T6, намалява, когато miR-146a-5p е свръхекспресиран. ( Б. ) miR-146a-5p инхибира растежа на LX-2 и HSC-T6 клетки, както се определя от анализите CCK-8. Стойностите са средни ± SD, * P
( ДА СЕ, ° С ) потенциални места за свързване на miR-146a-5p в 3'UTR на Wnt1 и Wnt5a. ( Б., д ) HEK-293T клетки бяха трансфектирани с луциферазен репортерен вектор, съдържащ див тип или мутантна 3'UTR форма на Wnt1 и Wnt5a, в присъствието на имитатори на miR-146a-5p, имитиращ контрол, инхибитор miR-146a -5p и контрол на инхибитора и след това се оценява за активността на репортер на луцифераза на 48 часа след трансфекцията. Стойностите са средни ± SD, * P # P # P ## P
( ДА СЕ ) нива на иРНК и протеини ( Б. ) на β-катенин, GSK-3β и NFAT5 при мишки, хранени с черен дроб с MCD диета и контроли. ( ° С ) HSC-T6 бяха трансфектирани с miR-146a-5p инхибитор или контрол на инхибитора, имитираха miR-146a-5p или имитираха контрол в продължение на 48 h. Нивата на иРНК и протеини ( д ) на β-катенин, GSK-3β и NFAT5 са анализирани съответно RT-PCR в реално време и Western blotting. За контрол на натоварването се използва control-актин. Стойностите са средни ± SD, ** P
В заключение идентифицирахме чернодробните miRNAs и оценихме моделите на тяхната експресия в индуциран от MCD безалкохолен фиброзиращ стеатохепатит с помощта на микрочипове. Сред валидираните miRNAs, miR-146a-5p има значително регулиране надолу при безалкохолен фиброзиращ стеатохепатит и активирани HSC. Свръхекспресията на miR-146a-5p допринася за развитието на чернодробна фиброза, като инхибира пролиферацията, активирането на HSC и отлагането на колаген, потискайки Wnt сигналния път. Следователно, miR-146a-5p може да служи като нов регулатор в патогенезата на безалкохолния фиброзиращ стеатохепатит.
Методи
Животински модели на безалкохолен фиброзиращ стеатохепатит
Осемседмични мъжки мишки C57BL/6J бяха отгледани и настанени, както беше описано по-рано. Безалкохолен фиброзиращ стеатохепатит се предизвиква чрез хранене на мишките с MCD диета (Research diets, Inc., NJ, New Brunswick, USA) в продължение на 8 седмици. Междувременно мишките бяха хранени с диета, допълнена с холин битартат и DL-метионин (Research diets, Inc., NJ, New Brunswick, USA) като контроли. В края на експеримента всички животни бяха умъртвени под упойка и кръвни проби бяха събрани от бедрената артерия за биохимичен анализ. Черният дроб се фиксира частично в 10% формалин за хистологичен анализ или бързо се замразява в липиден азот, последвано от съхранение при -80 ° C във фризера, докато се наложи. Всички протоколи и процедури са извършени в съответствие с насоките на Комитета за грижа и използване на лабораторни животни в Хъбей и са одобрени от Комитета по етика на експерименталните животни на Медицинския университет в Хъбей.
Хистологичен анализ и биохимичен анализ.
Секции от вграден в парафин черен дроб, оцветени с хематоксилин и еозин и оцветени с трихроматизъм на Masson (с дебелина 5 μm), се оценяват за чернодробна стеатоза, възпаление и фиброза, както е описано по-рано съгласно критериите на Brunt и системата за хистологична оценка за NAFLD, издадена от Патологичния комитет на мрежата за клинични изследвания за неалкохолен стеатохепатит. Серумните нива на ALT и AST са измерени чрез ензимен кинетичен метод, като се използва автоматизиран биохимичен анализатор (Olympus AU2700, Япония), съгласно инструкциите на производителя.
Анализ на MicroRNA Microarray
Обща РНК беше извлечена от 20 mg чернодробна тъкан от мишки, хранени с MCD диета, и мишки, хранени с контролна диета (n = 3 мишки/група), използвайки реагента TRIzol (Invitrogen), съгласно инструкциите на производителя. Изследването на микроРНК микрочипове µParaflo ™ се извършва с помощта на доставчик на услуги (LC Sciences, Хюстън, Тексас, САЩ). Анализът започва от 4 до 8 ug от общата проба на РНК, която е удължена 3 'с поли (А) опашка, използвайки поли (А) полимераза. След това към поли (А) опашката беше прикрепен олигонуклеотиден етикет за последващо оцветяване с флуоресцентно багрило. Хибридизацията се извършва за една нощ на микрофлуиден чип µParaflo с помощта на микроциркулационна помпа (Atactic Technologies). След РНК хибридизация, конюгираното с маркировка Cy3 багрило беше циркулирано през микрофлуидния чип за оцветяване на багрилото. Флуоресцентните изображения бяха събрани с лазерен скенер (GenePix 4000B, Molecular Device) и цифровизирани със софтуер за анализ на изображения Array-Pro (Media Cybernetics). Данните бяха анализирани чрез първо изваждане на фона и след това нормализиране на сигналите с помощта на LOW филтър (Локално претеглена регресия).
QRT-PCR анализ
Общата РНК се изолира и екстрахира от замразени чернодробни тъкани с реагент TRIzol (Invitrogen). CDNA беше синтезирана с помощта на miRNA-специфичен праймер за обратна транскриптаза на стволови контури (RiboBio, Гуанджоу, Китай) или олиго dT праймери (Thermo, Waltham, MA, USA). Различно, qRT-PCR беше извършена върху PCI система в реално време ABI 7500 (Applied Biosystems, Фостър Сити, Калифорния, САЩ), използвайки SYBR Green Master Mix (CoWin Biotech, Пекин, Китай). Относителното изобилие на miRNA се нормализира до U6 малка ядрена РНК и нивата на генна експресия се нормализират спрямо референтен ген на ендогенна глюцералдехид фосфат дехидрогеназа (GAPDH). Относителното количество на всяка miRNA и гени се измерва, използвайки метода 2 -ΔΔCt. Всички qRT-PCR реакции се провеждат в три екземпляра. Праймерите, използвани за qRT-PCR, са показани в Таблица 1.
Таблица в пълен размер
Идентифициране на потенциални миРНК цели
РНК интерференция и трансфекция
HSC-T6 клетките се трансфектират с siRNA срещу Wnt1 или siRNA срещу Wnt5a и контролират siRNA (Ribo Bio, Гуанджоу, Китай), състояща се от кодирана последователност, която няма да доведе до специфично разграждане на клетъчно съобщение. SiRNAs бяха трансфектирани в HSC-T6 клетки, използвайки липофектамин 2000 (Invitrogen). Ефективността на отстраняване беше оценена чрез qRT-PCR и Western blot. Синтезираните олигоси са показани в таблица 1
Имуноцитохимичен анализ.
HSC се култивират върху предметни стъкла и се провеждат експерименти за трансфекция, както е описано по-горе. Клетките се фиксират в 4% параформалдехид за 15 минути и се промиват с PBS три пъти. Клетките се накисват в X-Triton100 за 20 минути и се измиват с PBS три пъти. След това клетките бяха блокирани с 5% говежди серумен албумин в PBS за 1 h, последвано от инкубация с първични антитела срещу десмин (ProteinTech Group, Чикаго, САЩ) и α-SMA (Novus Biologicals, Littleton, USA). USA за 16 h при 4 ° C за една нощ. След промиване с PBS три пъти, вторичното антитяло се прилага и се инкубира в продължение на 1 час. След допълнително измиване клетките се анализират чрез флуоресцентна микроскопия.
Анализ на клетъчна пролиферация
Пет часа след трансфекция с мимичен miR-146a-5p или имитиращ контрол, LX-2 и HSC-T6 клетки бяха повторно засети в 96-ямкови плаки, с плътност 5 × 10 3 клетки на ямка за 1, 2, 3, 4, 5 д. Клетките бяха изследвани за пролиферация, като се използва комплект за преброяване на клетки-8 (CCK-8, Dojindo, Кумамото, Япония), съгласно инструкциите на производителя. Експериментите са извършени три пъти независимо.
Анализ на Western Blot
Общите протеини бяха извлечени от чернодробна тъкан и клетки, използвайки радиоимунопреципитационен буфер (RIPA). 80 ug проби от протеини се разделят върху 10 или 12% SDS-PAGE гел и се прехвърлят в PVDF мембрани (Millipore Corporation, Billerica, MA, USA) чрез електроосаждане. Мембраните бяха блокирани за 60 минути в буфер, съдържащ 0,1% Tween-20 и 5% мляко. Мембраните бяха инкубирани през нощта при 4 ° C с първични антитела срещу α-SMA, Col-1, MMP-2 (Bioss, Пекин, Китай), Smad7 (Novus Biologicals, Littleton, USA), Wnt1 (Abcam, Cambridge, MA, САЩ), Wnt5a (Novus Biologicals, Littleton, САЩ), Β-катенин, GSK-3β (ProteinTech Group, Чикаго, САЩ), NFAT5 (Санта Круз, Калифорния, САЩ). Имунните комплекси бяха открити с конюгирани вторични антитела с хрян пероксидаза (HRP) (ProteinTech Group, Чикаго, САЩ) и след това се визуализираха по метода ECL. Control-актин (Boster, Wuhan, Китай) служи за контрол на зареждането. Интензивността на всяка интересуваща протеинова лента е количествено определена чрез денситометрия с помощта на софтуера Quantity One 4.6.3 (Bio Rad).
Анализ на активността на луциферазата
Последователността на сегментите с дивия тип (WT) или мутантния (Mut) семен регион на Wnt1 и Wnt5a беше синтезирана и клонирана в психичен TM-луциферазен вектор (Promega, Madison, WI, USA). Xho I и Not I сайтове за ограничение. Като отрицателна контрола се използва празен вектор на репортер на луцифераза. HEK-293T клетки се култивират в 24-ямкови плаки и всяка ямка се трансфектира с 200 ng от съответните psi-CHECK2 3'UTR конструкции и miR-146a-5p 50 nM имитиращ или имитиращ контрол и контрол на инхибитора или 100 nM инхибитори, използвайки реагент за трансфекция на Lipofectamine 2000 (Invitrogen, Carlsbad, CA), съгласно протокола на производителя. След 5 часа, OptiMEM трансфекционната среда (Invitrogen, Калифорния, САЩ) беше заменена с DMEM. Клетките се събират и анализират 48 часа след трансфекцията, като се използва система за анализ на луцифераза (Promega). Синтезираните олигоси са показани в таблица 1.
статистически анализ
Данните са изразени като средно ± стандартно отклонение. Статистическият анализ беше извършен със SPSS 17.0. За статистически анализ са използвани еднопосочен дисперсионен анализ (ANOVA) и тест на Student. Смяташе се, че P
- Стремете се да запалите топлината в мастните клетки, които изгарят енергия
- Естествени популации на клетки убийци и цитотоксична активност при свине, хранени с мляко
- Тайните на радикалната физическа дейност на Майк Тайсън променят скъпото лечение със стволови клетки
- Затлъстяването открива как метаболизмът на имунните клетки регулира теглото TN
- Защо ракът на панкреаса е толкова смъртоносен