- Субекти
- Обобщение
- Въведение
- Резултати
- Ефект на кверцетин върху жизнения цикъл на HCV в клетки Huh-7.5
- Ефект на кверцетин върху жизнения цикъл на HCV в първичните човешки хепатоцити
- Когато се прилага директно върху HCV частици, кверцетин намалява тяхната инфекциозност.
- DGAT1, възможен кандидат за цел на кверцетин в контекста на HCV инфекция
- Ефект на кверцетин върху LD размера и субклетъчната локализация на HCV ядрения протеин
- Дискусия
- Материали и методи
- Реактиви, антитела, плазмиди и грундове.
- Клетъчна култура
- Кверцетин Анализ на цитотоксичността
- Производство на HCV, оценка и анализ на инфекцията.
- Вирусологичен анализ
- Нива на HCV РНК: репликационни анализи
- РНК изолация, обратна транскрипция и количествена полимеразна верижна реакция в реално време (RT-PCR)
- Производство на HCV псевдочастици
- DGAT тест за активност
- Имунофлуоресценция и оцветяване с маслено червено O
- Оценка на съвместно местоположение
- Статистически анализ
- Допълнителна информация
- Допълнителна информация
- Word документи
- Допълнителна информация
- Коментари
Субекти
Обобщение
Кверцетинът е естествен флавоноид, за който е доказано, че има свойства срещу вируса на хепатит С (HCV). Точните механизми, чрез които кверцетинът влияе върху жизнения цикъл на HCV, не са напълно изяснени. Оценихме ефекта на кверцетин на различни етапи от жизнения цикъл на HCV в заразени с HCV клетки Huh-7.5 и първични човешки хепатоцити (PHH). И при двата типа клетки кверцетинът значително намалява i) репликация на вирусния геном; ii) производството на инфекциозни HCV частици и iii) специфичната заразност на новопроизведените вирусни частици (съответно 85% и 92%, Huh7,5 и PHH). Освен това, когато се прилага директно върху HCV частици, кверцетинът намалява своята заразност с 65%, което предполага, че влияе върху целостта на вириона. Интересното е, че кверцетинът предотвратява индуцираната от HCV повишена регулация на диацилглицерол ацилтрансферазата (DGAT) и типичното локализиране на HCV ядрения протеин на повърхността на липидните капчици, за което е известно, че се медиира от DGAT. В заключение изглежда, че кверцетинът има преки и медиирани от гостоприемника антивирусни ефекти срещу HCV.
Въведение
Вирусът на хепатит С (HCV) е РНК вирус с положителна верига, принадлежащ към семейство Flaviviridae 1 със 7 основни генотипа 2. Спектърът на заболяването варира от остър до хроничен хепатит, цироза и хепатоцелуларен карцином.
Жизненият цикъл на HCV е тясно свързан с липидния метаболизъм на клетката гостоприемник. Механизмите, свързващи HCV инфекцията и липидния метаболизъм, включват 3, 4: (a) HCV циркулира като обогатени с липиди частици, наречени липовичастици (LVP) 5; (b) LVPs са HCV частиците с най-висока инфекциозност поради тяхната асоциация с липопротеини 6; (в) няколко рецептора, участващи в усвояването на липидите, например, рецепторът за липопротеини с ниска плътност (LDL), Niemann-Pick C1-подобен 1 (NPC1L1) 7 и SR-B1, участват в навлизането на LVP в хепатоцита 8; (d) Сглобяването на HCV се случва в непосредствена близост до липидни капчици (LD) 9, 10; (д) HCV инфекцията насърчава натрупването и преразпределението на LD в перинуклеарната област 11; (f) диацилглицерол ацилтрансфераза-1 (DGAT1), ензим, който синтезира триглицериди (TG) в ендоплазмения ретикулум, взаимодейства с основния протеин на HCV и участва не само в образуването на нова LD, но и в производството на инфекциозен HCV 12; (g) Съобщава се, че HCV изолира пътя на секреция на липопротеини с много ниска плътност (VLDL) за секреция на вирусни частици 13 .
Лечението с директно действащи антивирусни лекарства (DAA) е променило драстично резултатите от хепатит С. В действителност процентите на устойчив вирусен отговор (SVR) са достигнали рекордни нива (> 95%) 14, 15 без съответни нежелани събития. Цената обаче остава една от основните пречки за постигане на премахване на хепатит С, главно в страните с ниски и средни доходи 16 .
Резултати
Ефект на кверцетин върху жизнения цикъл на HCV в клетки Huh-7.5
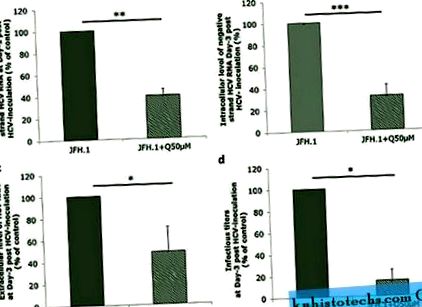
За да се оцени ефектът на кверцетина върху репликацията на генома на HCV, клетките Huh-7.5 бяха заразени с HCV, продуциран от клетъчна култура (HCVcc) от щама JFH1 и третирани с 50 μM кверцетин, т.е. концентрация при тази, която не се наблюдава токсичен ефект (фиг. S1A, a и b). Кверцетинът значително намалява вътреклетъчното количество на HCV РНК с отрицателна верига, отличителен белег за репликация на HCV геном, оценено на 1 ден след инокулация (61% ± 5,89% инхибиране; p = 0,0084) и на 3 ден след инокулация (68,38% ± 10% инхибиране;
Huh-7.5.1 клетки бяха заразени с JFH1 в продължение на 6 часа и след това третирани с 50 μM кверцетин (JFH1 + Q50 μM) или DMSO като контролен носител, в продължение на 24 часа ( да се ) или 72 часа ( b, d ). ( а, б ) Клетките се лизират, за да се определи количествено HCV РНК с отрицателна верига. ( c, d ) Културни супернатанти бяха събрани за определяне на извънклетъчното ниво на HCV РНК и титъра на инфекциозност. Резултатите се изразяват като процент от контрола върху превозното средство. Данните са представени като средни стойности ± SD, получени от три независими експеримента.
Изображение в пълен размер
Ефект на кверцетин върху жизнения цикъл на HCV в първичните човешки хепатоцити
PHHs бяха заразени с JFH1 (MOI от 2.5) в продължение на 6 часа и след това третирани с 50 μM кверцетин (JFH1 + Q50 μM) или DMSO като контрол на носителя, в продължение на 24 часа ( да се ) или 72 часа ( b, c ). ( да се ) Клетките се лизират, за да се определи количествено HCV РНК с отрицателна верига. ( b, c ) Културните супернатанти бяха събрани за определяне на извънклетъчно ниво на HCV РНК и титър на инфекциозност, съответно. Резултатите се изразяват като процент от контрола на носителя. Данните са представени като средни стойности ± SD, получени от два до три независими експеримента.
Изображение в пълен размер
Когато се прилага директно върху HCV частици, кверцетин намалява тяхната инфекциозност.
( да се ) JFH1-HCVcc вирионите се инкубират в присъствието на 50 цМ кверцетин (JFH1 + Q50 цМ) или DMSO като контролен носител, за 1 час при 37 ° С в безклетъчни условия, след което се използват за инокулиране на клетки Huh-7.5. Инфекциозността с HCV е измерена 72 часа по-късно чрез TCID 50 анализа. ( б ) Ефект на кверцетин върху стъпката на навлизане на HCV. Huh-7,5 клетки бяха третирани с 50 цМ кверцетин или DMSO като контролен носител и трансдуцирани с HCVpp или VSV-Gpp като контрола, 6 часа по-късно. Седемдесет и два часа след трансдукцията е извършен анализ на луцифераза. Резултатите са представени като средна стойност ± SEM във връзка с контрола, получен от три независими експеримента.
Изображение в пълен размер
DGAT1, възможен кандидат за кверцетин при определяне на HCV инфекция
Изследвахме ефекта на кверцетин върху експресията на ключови гени, участващи в липидния метаболизъм (фиг. S2, фиг. 4а). Резултатите показаха, че гените, участващи в липидния неосинтез или поглъщане [липопротеинов рецептор с ниска плътност (LDLr), синтаза на мастни киселини (FASN), ацетил-CoA карбоксилаза (ACC) и транскрипционен фактор, свързващи се с регулаторните елементи на стероли 1 (SREBP1c)] са регулирани нагоре в Huh7.5 заразени клетки. Експресията на иРНК DGAT1 също се е увеличила значително при HCV инфекция (1,79 пъти ± 0,35; p
Huh-7.5 клетки бяха заразени с JFH1 (1 MOI) за 72 h в присъствието или не на 50 цМ кверцетин. ( да се ) Нивата на експресия на DGAT mRNA бяха определени чрез RT-PCR. Резултатите бяха нормализирани с помощта на GAPDH и третирани с DMSO неинфектирани клетки бяха използвани като еталон. * p 12 и нашите предишни данни 30, решихме да проучим допълнително въздействието на кверцетина върху ролята на DGAT в контекста на HCV инфекция.
DGAT са ключови микрозомни ензими в биосинтеза на TG, а DGAT1 е ключов фактор гостоприемник за HCV инфекция. В действителност, DGAT1 взаимодейства с основния протеин на HCV, който образува вирусния нуклеокапсид, и е необходим за трафика на основния протеин към LDs, което е от съществено значение за производството на инфекциозни вириони 12. По-рано е съобщено, че кверцетин намалява синтеза на TAG, отчасти чрез ефект върху активността на DGAT 26, 27, 31, 32 .
След това тези резултати бяха потвърдени на ниво DGAT активност, с 2,29 ± 0,23-кратно увеличение на HCV-заразени Huh-7,5 клетки в сравнение с неинфектираните контролни клетки (p = 0,015) (Фиг. 4b). Интересното е, че повишената HCV-индуцирана активност на DGAT може да бъде напълно предотвратена чрез лечение на клетки, заразени с кверцетин (фиг. 4), което предполага, че DGAT е една от целите на кверцетина в Huh-7.5 клетки, заразени с HCV.
Ефект на кверцетина върху LD размера и субклетъчната локализация на HCV ядрения протеин
Освен това намалява степента на инфекция, когато се прилага директно върху вириони. Освен това, способността за заразяване на новопроизведените вирусни частици е намалена чрез третиране с кверцетин.
Изображение в пълен размер
В заключение ние демонстрираме, че кверцетинът е насочен към вирусни и гостоприемни фактори и следователно пречи на инфекциозния цикъл на HCV на различни етапи. Нашите резултати допълнително потвърждават, че HCV секвестира липидния метаболизъм на гостоприемника, за да изпълни своя жизнен цикъл от сглобяване до стъпки на репликация. Кверцетинът предотвратява субклетъчната локализация на основния протеин в LDs, което сочи към важен ефект на кверцетина върху липидния метаболизъм. В допълнение, кверцетинът може да намали инфекциозността на HCV чрез поне два различни механизма: (i) когато се прилага върху продуцентски клетки, той влияе върху морфогенезата на инфекциозните частици и (ii) когато се прилага върху вириони, влияе върху тяхната цялост.
Материали и методи
Реактиви, антитела, плазмиди и грундове.
Всички реагенти, плазмиди и праймери, използвани в това проучване, са описани в подкрепящата информация (Таблица S1).
Клетъчна култура
Клетки от човешки ембрионален бъбрек (HEK) 293T и човешки хепатом (Huh-7 и Huh-7.5) са култивирани в модифицираната от Dulbecco модифицирана среда на Eagle с ниско съдържание на глюкоза (DMEM), допълнена с 10% фетален говежди серум (FBS), 100 U/ml пеницилин, 100 U/ml стрептомицин и 2 mM L-глутамин в овлажнена атмосфера при 37 ° C и 5% CO 2. (всички от Invitrogen Life Technologies). Експериментите с PHH са проведени в съответствие с френските закони и насоки. PHH, закупен от Biopredic International (Rennes, Франция), е изолиран от очевидно нормална чернодробна тъкан, получена от възрастни пациенти, подложени на частична хепатектомия за лечение на метастази и серонегативни за HCV, вирус на хепатит В и човешки имунодефицитен дефицит, с информирано съгласие. всички пациенти. и споразумение на Ministère de l'Enseignement Supérieur et de la Recherche (ID: AC-2013-1754). Експерименталните протоколи бяха одобрени от френския национален комитет по етика (одобрение № D34-172-16). Прясно изолирани PHH се посяват с плътност 1,6 х 105 жизнеспособни клетки/cm2 върху покрити с колаген плочи и се поддържат в първична култура, както е описано по-рано 29 .
Кверцетин Анализ на цитотоксичността
За да се тества цитотоксичният ефект на кверцетин, Huh-7.5 и PHH клетки се посяват в 6-ямкови плаки и се третират с 50 цМ кверцетин в продължение на 72 часа. За контрол се използва диметилсулфоксид (DMSO). Жизнеспособността на клетките Huh-7.5 беше оценена чрез тест за изключване на трипан синьо. За да се оцени цитотоксичността на кверцетин в PHH, активността на лактат дехидрогеназата, освободена в супернатантите на културата, беше измерена с анализа на нерадиоактивната цитотоксичност CytoTox 96R (Promega) и съотношението на изтичане на лактат дехидрогеназа спрямо контрола на носителя, както преди изчислено. описано 39 .
Производство на HCV, оценка и анализ на инфекцията.
За да се получат HCVcc частици, Huh-7.5 клетки (4 × 10 6) се електропорират с 5 μg in vitro транскрибирана JFH1 RNA 40 в цял ръст (генотип-2а), като се използва комплект нуклеофектор на клетъчна линия Amaxa (260 V, 950 μF Lonza ) Културната супернатанта се събира след 72 h, филтрира се през мембрани от поливинилиден дифлуорид с размер на порите 0,45 μm и се титрува чрез инфектиране на наивни Huh-7,5 клетки чрез серийно разреждане. Клетките се фиксират след 72 часа с метанол при -20 ° С и се имунооцветяват, използвайки ядро анти-HCV антитяло (С7-50). Изчислена е 50% инфекциозна доза от тъканна култура (TCID 50), както е съобщено 41. Вирусни запаси с висок титър бяха използвани за инокулиране на клетки Huh-7.5 или PHH при MOI от 1 и 2.5, съответно.
Вирусологичен анализ
Нива на HCV РНК: репликационни анализи
РНК изолация, обратна транскрипция и количествена полимеразна верижна реакция в реално време (RT-PCR)
Общата РНК се извлича с използване на Trizol 44. Пробите от РНК се третират с DNaseI. Общата РНК се транскрибира обратно, използвайки налични в търговската мрежа комплекти (QuantiTect Rev. Transcription Kit; Qiagen, Hilden, Германия), съгласно инструкциите на производителя. Конкретните използвани праймери са изброени в допълнителната таблица и глицералдехид 3-фосфат дехидрогеназата (GAPDH) е използвана като справка за нормализиране. Нивата на генна експресия се определят по метода Delta Ct. Промяната на гънките се изчислява като съотношение проба/контрол в три независими експеримента.
Производство на HCV псевдочастици
Плазмидът phCMV 1b9.9, съдържащ луцифераза като репортерен ген, се използва за получаване на HCV псевдочастици (HCVpp) съгласно описания метод 45. Постъпването на VSV-Gpp беше оценено като контрола. Контролните псевдочастици са генерирани с гликопротеина VSV-G 46. Четиридесет и осем часа анализ на луцифераза след трансдукция беше извършен с помощта на комплект система за анализ на двойна луцифераза (Promega) съгласно протокола на производителя.
DGAT тест за активност
Имунофлуоресценция и оцветяване с маслено червено O
Huh-7.5 клетки бяха засяти в 24-ямкови плаки с покривни стъкла за 24 h и след това заразени с JFH1. След 6 часа клетките се третират с 50 цМ кверцетин в продължение на 72 часа. Клетките се промиват два пъти с PBS и се фиксират с параформалдехид (4%) в продължение на 10 минути и се проникват с 0.2% Triton X-100 в продължение на 2 минути. Клетките се инкубират с анти-ядрото антитяло (1: 300) и конюгираното с Alexa 488 вторично антитяло (1: 500). Ядрата бяха оцветени с 40,6-диамидино-2-фенилиндол (DAPI) (1: 1000) в продължение на 30 минути при стайна температура, а неутралните липиди бяха оцветени с маслено червено O (ORO), както беше описано по-горе 48. Изображенията са получени с конфокален микроскоп (LSM700Meta, Zeiss) с помощта на 63x обектив и повърхността на LD е изчислена с помощта на софтуера Metamorph (Molecular Devices Corporation, Сънивейл, Калифорния).
Оценка на съвместно местоположение
Клетъчното местоположение на ядрото около LDs беше анализирано с помощта на софтуера Imaris. Резултатите са изразени съгласно коефициента на Manders, описан като статистическа стойност, която се основава на коефициента на Pearson със средните интензитети, взети от математическия израз. Този коефициент варира от 0 до 1 с 0, съответстващ на неприпокриващи се изображения и 1, съответстващ на 100% съвместно разположение.
Статистически анализ
Непрекъснатите променливи са описани като средства ± SD или SEM на минимум три независими експеримента. Тестът на Student е използван за сравнение между групите. Стойностите на P P
- Съпътстващ ефект на вируса върху храната, това, което трябва да знаем; Жив и здрав
- Ефект от експериментално лечение с флавоноид кверцетин върху развитието на
- Кои са основните вируси на хепатит, какви симптоми причиняват и как се предават и
- Ефект на интервенционна програма върху начина на живот чрез средиземноморска диета с
- Ефект от промените терапия; съвети за начина на живот относно функцията; n ендотелен при пациенти