Испанската асоциация по педиатрия има за една от основните си цели разпространението на строга и актуална научна информация за различните области на педиатрията. Anales de Pediatría е органът за научно изразяване на асоциацията и представлява превозното средство, чрез което сътрудниците комуникират. Той публикува оригинални трудове за клинични изследвания в педиатрията от Испания и страни от Латинска Америка, както и преглед на статии, изготвени от най-добрите специалисти във всяка специалност, годишните съобщения на конгреса и протоколите на Асоциацията, както и ръководства за действие, изготвени от различните общества/Специализирани Секции, интегрирани в Испанската асоциация по педиатрия. Списанието, еталон за испаноезичната педиатрия, е индексирано в най-важните международни бази данни: Index Medicus/Medline, EMBASE/Excerpta Medica и Index Médico Español.
Индексирано в:
Index Medicus/Medline IBECS, IME, SCOPUS, Разширен индекс за научно цитиране, Доклад за цитиране на списания, Embase/Excerpta, Medica
Следвай ни в:
Импакт факторът измерва средния брой цитати, получени за една година за произведения, публикувани в публикацията през предходните две години.
CiteScore измерва средния брой цитати, получени за публикувана статия. Прочетете още
SJR е престижна метрика, базирана на идеята, че всички цитати не са равни. SJR използва алгоритъм, подобен на ранга на страницата на Google; е количествена и качествена мярка за въздействието на дадена публикация.
SNIP дава възможност за сравнение на въздействието на списанията от различни предметни области, коригирайки разликите в вероятността да бъдат цитирани, които съществуват между списанията на различни теми.
Дуктусният артериос е структура, която остава отворена по време на развитието на плода поради ефекта на високите нива на простагландини 1. След раждането нивата на простагландин намаляват и естествената тенденция на дуктуса е да се затвори спонтанно през първите 3 дни от живота. При недоносените бебета, особено тези с белодробно заболяване, тези промени не настъпват по същия начин и каналът вероятно ще остане отворен след раждането 2 (патентен дуктус артериос [PDA]). Постоянството на артериален дуктус със значителен аортопулмонален шънт може да усложни еволюцията на недоносените пациенти; наблюдавано е, че обуславя повишен риск от интравентрикуларен кръвоизлив, некротизиращ ентероколит, бронхопулмонална дисплазия и смърт 2-5. Честотата на PDA варира в зависимост от гестационната възраст и теглото при раждане и е по-висока, колкото по-ниска е теглото и гестационната възраст; при недоносени бебета с много ниско тегло при синдром на дихателен дистрес е близо 40% на третия ден от живота 2,6,7. В нашия отдел настоящата честота на PDA е 29% при тези под 1500 g и нараства до 50% при тези под 1000 g.
Индометацин, инхибитор на синтеза на простагландини, е най-широко използваното лечение при затварянето на PDA (или профилактично, или веднъж диагностицирано) 2,4,5,8. Въпреки доказаната ефикасност обаче, употребата му е свързана с усложнения поради намалена церебрална, бъбречна и мезентериална перфузия 9-15 .
През последните години се появиха проучвания, които стигнаха до заключението, че ибупрофенът, друг инхибитор на синтеза на простагландини, е също толкова ефективен при затварянето на PDA, но с по-малко хемодинамични ефекти 16-23, като не обуславя намаляване на притока на кръв към мозъка, червата и бъбреците.
Следователно е разработено проспективно рандомизирано проучване за сравняване на ефикасността и безопасността на ибупрофен спрямо индометацин при недоносени бебета със симптоматично APD. Основната цел беше затварянето на канала след назначеното лечение, а вторичните цели - скоростта на повторно отваряне, необходимостта от втори кръг от спасително фармакологично лечение, необходимостта от хирургично затваряне, честотата на усложнения (некротизиращ ентероколит, чревна перфорация, бъбречно засягане, интравентрикуларен кръвоизлив, други кръвоизливи, бронхопулмонална дисплазия) и смърт.
Пациент и методи
Уча дизайн
Проспективно клинично изпитване с произволно разпределение и контролна група, одобрено от изследователската комисия и етичната комисия на нашия център.
Изследването е проведено в отделението за интензивно лечение на неонатологичната служба на университетската болница La Fe във Валенсия (отделение от ниво III, препоръка в общността, с 16 легла и 460 годишни приема). Пациентите са избрани между януари 2003 г. и юли 2004 г. с предварително информирано съгласие на родителите.
Използваните критерии за включване са недоносени бебета с гестационна възраст под 34 седмици, през първата седмица от живота, представящи PDA с хемодинамично значим шънт, диагностициран чрез ехокардиография и изискващ вентилационна подкрепа. Пълно доплерово ехокардиографско проучване (Hewlett Packard Sonos 2000 с преобразувател 7,5 MHz) е извършено при всички деца от детски кардиолози от новороденото звено, като се има предвид наличието на доминиращ аортопулмонален шунт със съотношение PDA/белодробен ствол като хемодинамично значим шънт> 0,3 и обръщане на диастоличния поток в коремната аорта 16,24 .
Пациентите, които са представили диуреза по-малка от 1 ml/kg/h за 8 часа преди лечението, креатинин над 1,8 mg/dl, тромбоцити под 60 000/μl, активно кървене (трахеално, храносмилателно или бъбречно) са изключени наскоро., периинтравентрикуларен кръвоизлив (3-4 степен) или тежка хипербилирубинемия.
След получаване на информирано съгласие от своите родители, пациентите бяха рандомизирани да получат една от двете интервенции:
1. Индометацин (Inacid DAP интравенозно MSD), при 0,2 mg/kg/доза на всеки 12 часа, общо 3 дози, прилагани чрез интравенозна инфузия в продължение на 30 минути.
2. Ибупрофен (ибупрофен Orphan Europe®), който се използва с начална доза от 10 mg/kg, последвана от 2 дози от 5 mg/kg на всеки 24 часа, чрез интравенозна инфузия в продължение на 20 минути.
След минимум 48 часа от началото на този първи цикъл на лечение е извършен ехокардиографски контрол. Ако каналът остава отворен и със значително клинично въздействие, като спасяване се прилага друг кръг от 3 дози от същото лекарство, първоначално назначено. Ако това второ лечение също е неуспешно или приложението му е противопоказано и каналът продължава да има значителни последици, ние пристъпваме към хирургично затваряне.
Съществуването на бронхопулмонална дисплазия се определя като нужда от допълнителен кислород на 28 дни от живота.
Бъбречната функция се оценява чрез измерване на нивата на диуреза и креатинин по време на лечението. Смята се, че е имало преходна бъбречна дисфункция (TRD), когато е имало намаляване на диурезата до 50% от базалната скорост, но без да се достигне по-малко от 1 ml/kg/h или увеличение на креатинина с 50% над базовото ниво но по-малко от 1,8 mg/dl. Преходната бъбречна недостатъчност (IRT) се определя като намаляване на диурезата под 1 ml/kg/h или повишаване на креатинина над 1,8 mg/dl.
Всички пациенти са били управлявани в съответствие с клиничните насоки и протоколи на службата, а аналитичният и кардиологичен контрол, считани за адекватни, са били извършвани до изписването им от болница.
Изчисляване на размера на извадката
Изчисляването на размера на извадката се основава на основната зависима променлива на изследването. Известно е, че в популация, подобна на нашата, делът на спонтанните PDA затваряния е 35%, а индометацинът постига степен на затваряне от 79% 4. Приемайки пропорция от 0,79 в контролната група (индометацин), приемане на риск α от 0,05 и риск β от 0,20 в двустранен контраст (статистическа мощност от 80%) и оценка на степента на загуба от 5% проследяване се изисква глобална извадка от 48 субекта, за да се открие разлика, равна на или по-голяма от 40% между двете проучвани групи. Използвано е приближението на Arcsine, проведено с програмата Granmo 5.2 25 .
За да се постигне подобен брой пациенти и в двете групи, е генерирана последователност на рандомизация в две групи, като се използва процедура с балансиран блок с четири елемента. Използвана е поредица от компютърно генерирани произволни числа, използвайки функцията "Random" на програмата MS-Excel XP®, и процедурата, описана от Friedman et al 26, е приложена към това. Веднъж генерирана, последователността на рандомизацията беше скрита, използвайки техниката на запечатан непрозрачен плик.
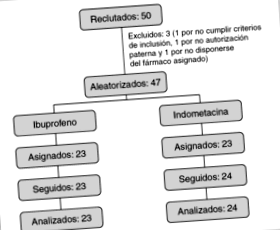
Фигура 1 показва блок-схема, в която са представени пациентите, участващи във всеки от етапите на изследването.
Фигура 1. Диаграма на участниците и последващи действия.
От 50-те пациенти, които се считаха за кандидати за участие, трима бяха изключени преди рандомизирането: един, защото родителите отказаха да дадат съгласието си; друг, тъй като не отговаря на един от критериите за включване (неговата постнатална възраст надхвърля 7 дни), и друг, защото когато щеше да бъде рандомизиран, беше забелязано, че едно от двете лекарства не се предлагаше в аптеката за услуги. Шанс накрая разпредели 24 за лечение с индометацин и 23 с ибупрофен, като всички те бяха проследени до края.
Таблица 1 показва, че рандомизацията генерира две напълно сравними и взаимозаменяеми кохорти в техните базови характеристики преди приложението на изследваното лекарство.
Фармакологично затваряне на канала е постигнато при 85,1% (точно 95% CI = 71,7-93,8) от всички недоносени деца. Както може да се види в Таблица 2, честотата на затваряне на лекарството е сходна и в двете кохорти: 87,5% в групата, получавала индометацин, и 82,6% в тази, която е получавала ибупрофен (р = 0,7).
Нито са установени статистически значими разлики между двете кохорти по отношение на повторното отваряне след затваряне, необходимостта от два курса на наркотици или дела на хирургичните лигации. От 9 пациенти, при които не е постигнато фармакологично затваряне, един умира, двама не са лигирани поради липса на клинични или хемодинамични последици и е извършено хирургично лигиране при останалите шест: двама в групата на индометацин и четири в групата на ибупрофен.
Честотата на други усложнения е сходна и в двете групи (Таблица 2). Нито един пациент, лекуван с ибупрофен, не е имал коремно заболяване, което се е появило в групата на индометацин (две чревни перфорации и една некротизираща ентероколит). Седем пациенти (29%) в групата на индометацин са страдали от TRD в сравнение с двама (9%) в групата на ибупрофен. В групата на индометацин един разви IRT, а нито един в групата на ибупрофен.
Нито една от двете кохорти не е имала по-висока честота на бронхопулмонална дисплазия (30% индометацин срещу 29% ибупрофен), тежък периинтравентрикуларен кръвоизлив (степени III-IV) (4% в групата на индометацин срещу 9% в групата на ибупрофен) или смъртни случаи (8,3 % срещу 8,7%) (Таблица 2). 4-те починали пациенти са имали тегло при раждане по-малко от 750 g и гестационна възраст под 26 седмици; починали на 5, 7, 9 и 131 дни.
По подобен начин не са установени статистически значими разлики в продължителността на механичната вентилация (p = 0,19), в продължителността на допълнително подаване на O 2 (p = 0,78) или в продължителността на престоя в отделението за интензивно лечение за новородени (NICU) ( p = 0,92).
Основната цел на това проучване е да се определи дали ибупрофенът, прилаган като значимо лечение на кореновите канали, диагностициран при недоносени бебета през първата седмица от живота, е толкова ефективен, колкото индометацин. В нашата серия и двете лекарства се оказаха еднакво ефективни при затваряне на симптоматичен PDA със скорост на затваряне, подобна на тази, установена в други проучвания 16,17,21,28 .
Ибупрофен вече показа своята ефективност при затваряне на канала при животни 20,29. При хората мета-анализ на Cochrane Review 30 анализира осем проучвания, включващи общо 509 пациенти, сравняващи ефективността на ибупрофен спрямо индометацин при затваряне на канал и заключава, че нито едно проучване не открива значителни разлики в ефикасността на затварянето на PDA или нито мета -анализ.
Съвсем наскоро се препоръчва профилактичната употреба на ибупрофен 23,31 през първите часове от живота и се провеждат опити за оценка на неговата ефективност и безопасност при намаляване на честотата на PDA.
В нашето проучване не е доказано, че групата, лекувана с ибупрофен, има по-висок риск от бронхопулмонална дисплазия, въпреки че се налага втори курс на лечение по-често, въпреки че това се наблюдава в метаанализа Cochrane 2003, когато две проучвания са били оценени съвместно. това отделно не показва значителни разлики 17,21,30. Разликата може да бъде в честотата на други фактори, свързани с дисплазия, или в малкия размер на нашата извадка.
Нито са установени значителни разлики в скоростта на тежкия вътречерепен кръвоизлив. Дългосрочната неврологична еволюция не е оценена, което би било много интересно за бъдещи прегледи, тъй като експериментално е наблюдаван по-малък ефект на ибупрофен върху мозъчната циркулация и оксигенацията 18,22, с ползите, които това може да има върху невроразвитието.
При нито един от нашите пациенти не е имало епизоди на хипоксия, показателни за белодробна хипертония след приложението на ибупрофен, както е описано от Gournay et al 38,39, които откриват 3 случая на белодробна хипертония, след като ибупрофен е даден профилактично на недоносени бебета на възраст под 28 седмици. бременност през първите 6 часа от живота. Причината за това усложнение е неизвестна и е свързана с ранното приложение на лекарството, екстремната недоносеност на изследваната популация и разреждането, използвано за неговата употреба (THAM, тришидрокси аминометан). В нашия анализ и ибупрофенът, и индометацинът се разреждат с физиологичен разтвор или 5% глюкозен серум.
В заключение, в нашето проучване е показано, че ибупрофенът е толкова ефективен, колкото индометацин при затварянето на PDA. Няма значителни разлики в честотата на усложненията между двете групи, въпреки че лекуваните с ибупрофен имат по-малко бъбречни усложнения и никакви чревни усложнения. Няма промени в дихателната еволюция или оцеляване. Би било удобно да се извършват нови изследвания, които анализират по-широко белодробните усложнения и дългосрочната неврологична еволюция.
Искаме да изкажем благодарността си на д-р В. Модесто за сътрудничеството му в статистическия анализ на изследването.
- Giardia при зараза на кучета, симптоми и лечение - блогът на Arion
- Натурално пчелно млечице от Италия, 10-дневен цикъл на лечение
- 19-годишно момиче, което забави лечението, за да роди бебето си, умира от рак
- Las Cositas de EvaBeauty Моето мнение за интензивното нощно лечение с редуктор (Mercadona)
- По този начин преждевременното стареене и акнето влияят върху замърсяването на кожата ви