Обобщение
Този ръкопис предоставя протоколи, които използват вътреутробна електропорация (SUI), за да опишат структурната свързаност на невроните на ниво единична клетка и възбудимостта на маркираните с флуоресценция неврони. Хистологията се използва за характеризиране на дендритни и аксонални проекции. записването на цели клетки на остри резени се използва за изследване на възбудимостта.
Резюме
Нервната система се състои от огромен набор от различни типове неврони. Тези невронални субпопулации се характеризират, наред с други характеристики, с техните отделни дендритни морфологии, техните специфични модели на аксонална свързаност и техните селективни реакции на стрелба. Молекулярните и клетъчните механизми, отговорни за тези аспекти на диференциацията по време на развитието, все още са слабо разбрани.
Тук описваме комбинираните протоколи за маркиране и характеризиране на структурна свързаност и възбудимост на кортикалните неврони. Модификацията на протокола за вътреутробна електропорация (SUI) позволява маркирането на оскъдна популация от неврони. Това от своя страна позволява идентифицирането и наблюдението на дендритите и аксоните на отделните неврони, точното характеризиране на ламинарното местоположение на аксоналните проекции и морфометричен анализ. SUI може също да се използва за изследване на промените в възбудимостта на дивия тип (WT) или генетично модифицирани неврони чрез комбиниране на остри резени с запис на цели клетки на електропорирани мозъци. Тези две техники допринасят за по-доброто разбиране на свързването на структурна и функционална свързаност и на молекулярните механизми, които контролират невроналното разнообразие по време на развитието. Тези процеси на развитие имат важни последици за аксоналното свързване, функционалното разнообразие на невроните и биологията на когнитивните разстройства.
Въведение
Развитието на дендритни и аксонални структури е важен аспект на регулирането на веригите в нервната система, включително в мозъчната кора. Той играе критична роля по време на селективното свързване на различните невронни субпопулации. Няколко скорошни доклада показват, че в допълнение към свързаността, молекулярното разнообразие на невроните се отразява и чрез придобиването на много специфични режими на стрелба. Механизмите, които определят възбудимостта и свързаността на различните невронални подтипове по време на развитието, както и тяхната степен на координация, все още са слабо разбрани. 1, 2.
Въпреки че този протокол описва електропорацията на мишки в ембрионален ден (E) 15.5, тази техника може да се извърши на всяка възраст между E9.5 и 3 дни след раждането (P) 2 4. Докато е в ранните етапи на електропорацията е насочена към неврони и предшественици на таламуса и дълбоките слоеве на кората, по-напредналият етап на електропорация маркира повече повърхностни слоеве (напр. E15.5 IUE слой II-III неврони). В обобщение, комбинацията от SUI с едноклетъчен морфологичен анализ и електрофизиология е полезен инструмент за изясняване на молекулярните механизми, лежащи в основата на огромното структурно и функционално разнообразие на невроните в нервната система.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Протокол
Всички процедури за животни са одобрени от Комисията за грижа и заетост на животните в Мадрид в съответствие с националното и европейско законодателство (PROEX 118/14; PROEX 331/15). Поддържайте стерилни условия по време на процедурата.
1. Електропорация вътреутробно
ЗАБЕЛЕЖКА: Този протокол за SUI е адаптация на други, които са били публикувани по-рано 5, 6, 7. Този ръкопис описва протокол за SUI на ембриони E15.5, с модификации в репортерната стратегия, която позволява изучаването на морфологията на 8 индивида неврони и техните електрофизиологични свойства в отделен експеримент, използвайки стандартни GFP репортерни плазмиди.
2. Подготовка за операция
- Направете операция за оцеляване, като използвате асептични процедури. Гарантирайте стерилни условия, като маски, ръкавици, инструменти и хирургично поле. Стерилизирайте хирургически инструменти (скалпел, форцепс Adson, втвърдени фини ножици, извити ножици, форцепс Dumont и държач за игла).
- Изберете капиляри от боросиликатно стъкло 1/0,58 мм OD. флип капиляри 3. Ориентация за оптимална дължина на върха от 1 см след издърпване. Нарежете върха на иглата под ъгъл 30 ° с помощта на фини форцепс (Фигура 1Б).
- Пригответе 500 ml стерилен изотоничен разтвор (1x PBS или балансиран солев разтвор на Hank (HBSS)). Добавете пеницилин-стрептомицин 1: 100 и загрейте този разтвор до 37 ° C. Той може да се съхранява при 4 ° C след операцията.
- Инжектирайте подкожно предоперативна доза обезболяващи средства (напр. Карпрофен, 5 mg/kg телесно тегло).
- Поддържане на топлина на животните за операция, като ги поставите върху нагревателна подложка. Нагряване на чиста клетка до 37 ° C по време на следоперативно възстановяване.
- Анестезирайте бременна мишка C57BL/6 E15.5 с изофлуран. Първо влейте затворена камера с 3% изофлуран в 0,8 L/min кислород и оставете мишката на закрито, докато заспи. Преместете мишката в топъл компрес и поставете носа и устата в маска за доставка на изофлуран. Постепенно намалете анестезията по време на операцията до 1,5% изофлуран през маската. Потвърдете адекватната анестезия, като наблюдавате загуба на рефлекса на педала (щипка на пръста). Оптималната процедура отнема приблизително 20 минути и не повече от 45 минути.
- Нанесете очен мехлем, за да предотвратите изсъхването на очите по време на процедурата.
- Премахнете космите от област от
На 3 см от корема (с помощта на електрическа самобръсначка или крем за депилация). Измийте хирургичната зона със 70% импрегнирани с етанол памучни тампони, последвани от йод, напоен с памук. Повторете три пъти.
4. ДНК инжекция и електропорация
5. Край на операцията и след операцията
- Използвайте памучни пъпки, за да манипулирате матката обратно в майката. Напълнете коремната кухина със затоплен физиологичен разтвор (добавете приблизително 2 ml).
- Зашийте мускула с прости прекъснати шевове или непрекъснат шев. Използване на конци # 6-0s.
- Използвайте скоби, за да затворите външната рана. Погрижете се да отделите кожата от мускула преди телбод. Отстранете маската от носа.
- Оставете мишката да се възстанови за 30 минути в чистата топла клетка, преди да я поставите в помещението за животни. Не оставяйте животно без надзор, докато то не се съвземе достатъчно, за да запази позицията на стерна. Не поставяйте животно, което е претърпяло операция, в компанията на други животни, докато не се възстанови напълно.
- Наблюдавайте животното през дните след операцията. Прилагайте подкожни аналгетици (карпрофен, 5 mg/kg телесно тегло) на всеки 12 часа в продължение на 2 дни или в съответствие със законодателството за животните. Не са необходими допълнителни следоперативни грижи за кученцата.
6. Подготовка и анализ на проби
7. Анализ на изображения и
ЗАБЕЛЕЖКА: Целта на този протокол е да се получат записи на токови клеми на цели клетки на пирамидални неврони от слой II/III от клетки, визуално идентифицирани чрез експресия на GFP в мозъка на електропорирани мишки GFP-a (или всеки друг флуоресцентен протеин преди електропорация) . Това е адаптация на публикувани по-рано методи 17, 18. Използвайки този протокол, е възможно да се изследва ефектът от генетична модификация, въведена от SUI, върху електрическите свойства на неврона. Придобиването на специфични режими на стрелба е постепенен процес на диференциация, който включва динамичното изразяване на широк репертоар от йонни канали и което води до изразяване на преходни режими на стрелба преди късните постнатални етапи. Например, зрели електрически реакции не се наблюдават в слой II/III на соматосензорната кора на мишката преди P16 2, 19.
- Предпоставки за остри филийки
- Пригответе стерилни хирургически инструменти за отстраняване на мозъка на мишки: гилотина, за отстраняване на главата; малки ножици, за да отрежете черепа; форцепс, за отделяне на черепа от тъканта; шпатула за внимателно отстраняване на мозъчната тъкан от черупката му; машина за рязане на метал, за да се дисектира кората на две равни половини; и пастьорска пипета, за да преместите резените от вибратома (поставете ги в разтвор, съдържащ изкуствена цереброспинална течност (ACSF) за проверка, и след това прехвърлете ACSF филиите в зона за изчакване на инкубация).
- Пригответе 1 L ACSF, като използвате вода с висока чистота (двойно дестилирана вода), съдържаща 119 mM NaCl, 26 mM NaHCO3, 11 mM глюкоза, 2.5 mM KCl, 1.2 mM MgCl 2, 2.5 mM CaCl 2 и NaH 1 mM 2 PO 4. Титруване рН до 7,3 до 7,4 с HCl или NaOH. Регулирайте осмоларността на 290 mOsm.
- ACSF мехурчета с карбоген (95% O2/5% CO2) за 15 - 20 минути с помощта на тефлонови тръби (
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Представителни резултати
За да се характеризират морфологичните промени на невроните в детайли и по време на развитието им, е важно да се маркират невроните рядко. Разредената Cre-рекомбиназна система позволява експресията на ген от интерес в малка популация неврони, така че само онези неврони, които включват този ензим, експресират GFP (Фигура 1А). С тази стратегия, слой II-III е насочен и обозначен от IUE на E15.5. CAG-DsRed2 при 1 g/l, е съвместно електропориране като контрол и за идентифициране на положителни електропорирани мозъци при живи животни. Важно е, че след оцветяване с анти-GFP антитяло, сигналът е достатъчно силен, за да позволи ясна визуализация на техните дендритни морфологии и аксони. (Фигура 1D Y. И).
След SUI и електрофизиология се използва анализ на параметрите, получени от записи на цели клетки, за да се сравнят реакциите на задействане и възбудимостта на клетките, подложени на електропорация при различни условия. Могат да се получат различни параметри. Параметрите трябва да бъдат съобразени с конкретното изследване, използване на специфичен софтуер за анализ на скоби. Фигура 2С е пример за графиката на потенциалите за действие срещу входния ток, получен от записи на WT слой II-III неврон, който е бил електропориран при E15.5.
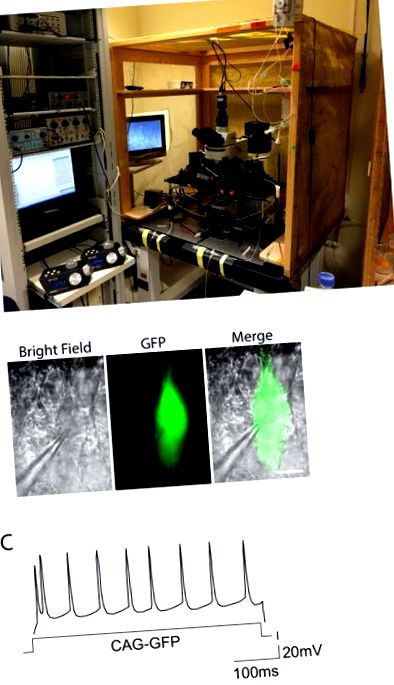
Фигура 2. Електрофизиологична настройка и пример за реакция на спусъка. ДА СЕ. Снимката показва инсталацията, използвана за експерименти с електрофизиологична скоба със зонални скоби. Конфигурацията е затворена в клетка на Фарадей за елиминиране на шума, а оборудването е на върха на антивибрационна маса. Моторизирани драйвери за микроманипулатори за електродите се виждат вляво. Б. Пирамидални неврони от мишка, електропорирана с наблюдаван GFP, при условия на ярко поле и зелена флуоресценция. Записващата пипета, прикрепена към GFP + клетка, е забележителна. Мащабна лента = 10 µ м. ° С. Модели на задействане на CAG-GFP към електропорационен слой II-III контрол на неврона, показващ типичния редовен обогатен отговор. Разпределението на потенциалите за действие се доближава до редовното разпределение през цялото времетраене на входния ток (ос X). Щракнете тук, за да видите по-голяма версия на тази фигура.сцена волтаж Електроди препратки E9.5 7 V, 100 ms, 3 импулса Платиновите електроди се придържат Matsui et al. 2011 г. 3 Е12.5 30 V, 50 ms, 3 - 5 импулса Електроди тип форцепс 3 мм Saito, T., 2006 12 Е15.5 35-48 V, 50 ms, 5 импулса Електроди тип форцепс 5-7 мм Родригес-Торнос и др. 2016 2, Saito, T., 2006 12 Р2 100 V, 50 ms, 5 импулса Електроди тип форцепс 5-7 мм Sonego и сътр. 2013 г. 4 Таблица 1: Условия на напрежение и електроди за електропорация на ембриони.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Дискусия
За успешен SUI се препоръчва да се вземат предвид някои съображения. На първо място, важно е операцията да се извърши за по-малко от 30 минути, за да се намали стресът върху майката и да се увеличат шансовете за оцеляване на потомството. Второ, най-трудната част от процедурата е инжектирането на ДНК, за да се извърши инжектирането през боросиликатни капиляри възможно най-гладко. Ако ембрионите се притиснат твърде силно, те могат да бъдат увредени. По отношение на отстраняването на проблеми с ембрионната смърт по време на инжектиране на ДНК, скосяването на върха под ъгъл 30 ° може да увеличи ефективността на този подход. Ако кранът не е наличен и капилярите се режат само с форцепс, правилният ъгъл може да бъде потвърден на дисекционния микроскоп. Изхвърлете неподходящите капиляри. И накрая, адаптирането на условията на електропорация към стадия на ембриона е важно, за да се увеличи степента на оцеляване (вж Маса 1).
Необходими са някои съображения относно реконструкцията на аксони и дендрити. За маркиране на отделни неврони адекватните концентрации на плазмида Cre са от съществено значение за получаване на добра, оскъдна експресия и избягване на объркващо припокриване на невронални проекции, принадлежащи към различни неврони. Въпреки че този протокол предлага използването на 4 ng/L, може да се наложи да се коригира плазмидната концентрация за всеки експеримент, в зависимост от използвания промотор, качеството на ДНК препарата и метода за количествено определяне на ДНК (например, намалете при 2 ng/l, ако се маркират твърде много неврони). в добавка напред, за проследяване на аксоните е важно да се реже под подходящ ъгъл, за да има целият неврон в една и съща равнина.
Критични стъпки за успешни записи на пластир-скоба са здравето на тъканите на острите резени и местоположението и изобилието на електропорираните GFP-положителни неврони. Ако стъпките за закърпване не успеят или се получат отклоняващи се реакции по време на записите, намалете времето за обработка на острите филийки. Ако GFP невроните са трудни за идентифициране и локализиране поради намаленото им число на остри срезове, уверете се, че в сместа за електропорация е включен достатъчно CAG-GFP плазмид. По отношение на основните ограничения на подходите, описани тук, техниката за закрепване на кръпка позволява записването на много различни параметри, които описват възбудимостта на неврона, но не оценява аспекти, които зависят от цялата верига. Освен това, както беше посочено по-рано, не всички невронални субпопулации са достъпни чрез SUI. В обобщение THfuturo e, тези техники могат да допринесат за по-нататъшния анализ на структурната и функционална свързаност на различните невронални субпопулации в мозъка.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Разкриване
Авторите декларират, че не са в конфликт на интереси.
Благодарности
Много сме благодарни на R. Gutiérrez и A. Morales за отличната техническа помощ и на LA Weiss за редактирането. CGB се финансира от испанското министерство на науката и иновациите (MICINN), FPI-BES-2012-056011. Тази работа е финансирана от безвъзмездна помощ от фондация BBVA и SAF2014-58598-JIN (MINECO) за М. Наварете и от безвъзмездна помощ от фондация Ramón Areces и безвъзмездни средства SAF2014-52119-R и BFU2014-55738-Redt (от MINECO) на М. Нието.