Резюме
Въведение
Йонните течности са клас соли, които имат температури на топене под 100 ° C. 12 За разлика от типичните неорганични соли, йонните течности имат широк диапазон на течността и могат да бъдат течни при стайна температура. Йонните течности са съставени от един или повече органични катионни центрове, като имидазолиум, фосфоний, пиридиний или амоний и са сдвоени с неорганичен или органичен анион, като метансулфонат, хексафлуорофосфат или халид. 13,14 Голямото разнообразие от възможни комбинации от катиони и аниони позволява голям брой композиции с регулируеми свойства. Освен това силните йонни взаимодействия в йонните течности са резултат от незначително парно налягане, негоримост и висока термична и електрохимична стабилност. 15.16
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Протокол
1. Синтез на йонни течни моно- и ди-фосфониеви комбинации с хлорид (Cl) и бис (трифлуорометансулфонимид аниони) (TFSI)
ЗАБЕЛЕЖКА: Описана е процедурата за моно-фосфониева йонна течност, притежаваща три хексила и децил алкилова верига, която обгражда фосфониевия катион и тази йонна течност е съкратена като моно-HexC10Cl. Същата процедура се повтаря, като се използва 1,10-дихлородекан, за да се получи йонната течност-ди фосфоний с висок добив и тази йонна течност е съкратена като di-HexC10Cl.
2. Характеризиране на йонни течности
3. Приготвяне на електролити
- Изсушете йонната течност под висок вакуум при 80 ° C през нощта при строго разбъркване, за да се осигури отстраняване на следи от вода.
- LiTFSI се суши при 70 ° С в продължение на три дни във вакуумна фурна.
- Прехвърлете йонната течност и безводната сол на LiTFSI от жабката.
- Добавете йонната течност (например, моно-HexC10TFSI, 4.50 g, 6.4 mmol) и LiTFSI (1.83 g, 6.4 mmol) в изсушена във фурна колба, съдържаща бъркалка. Сместа се разбърква една нощ, докато стане хомогенна, за да се получи концентрация от 1,6 М за електролита.
4. Производството на литиева батерия
- Тук в жабката под атмосфера на аргон поставете пружина и диск от неръждаема стомана на долния капак на клетката за монети. Поставете 2 LiCoO електрода с диаметър 12,7 mm (24 mg) върху диска от неръждаема стомана.
- Накиснете две парчета от сепараторите (порести полипропиленови мембрани) в йонния течен електролит, предварително приготвен при 60 ° C, на котлон за 15 минути.
- Добавете йонния течен електролит към повърхността на катода LiCoO 2, докато материалът бъде напълно покрит с електролит (≈ 0,5 ml).
- Поставете напоените с електролит дистанционни елементи в центъра на клетката на монетата. След това добавете още няколко капки йонен течен електролит (няколко микролитра) към сепараторите.
- Изрежете парче литиев метал с диаметър 12,7 мм в отделението за ръкавици. Поставете литиевия метал върху горната част.
- Затворете типа бутон и го запечатайте с маша в жабката.
- Прехвърлете клетката за монети от жабката и останалата част от клетката за 12 часа, преди да започнете батерията/електрохимичните тестове.
5. Работа на батерията при 100 ° C
- Поставете клетката за монети в пещ, работеща при 100 ° C, която има малък отвор в задната стена, където са резбовани проводниците на електрохимичната станция за изпитване. Свържете типа бутон към електрохимична станция за изпитване.
- Оставете клетката при 100 ° C за 30 минути, уравновесете при температурата.
- Изберете галваностатично зарядно-разрядно циклиране в електрохимичната станция за изпитване. Задайте броя на циклите на 500.
- Задайте зарядния ток на 500 mu и долната граница на напрежението на 4,2 V. Задайте 60 секунди време на почивка при 0 V след всяко зареждане.
- Задайте разрядния ток на 500 mu, а долната граница на напрежението - 3,0 V. Задайте време за почивка от 60 секунди при 0 V след всяко разреждане.
- Стартирайте цикъла на зареждане и разреждане при ток от 500 mu между 3.0 V и 4.2 V, използвайки софтуера. Оценете изхода на натоварване спрямо времето.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Представителни резултати
Йонните течности, моно- и ди-HexC10Cl HexC10Cl, се приготвят чрез нуклеофилна реакция и последваща реакция на халогениден обмен дава съответно моно-HexC10TFSI и ди-HexC10TFSI йонни течности. (Фигура 1А). 14 И четирите йонни течности бяха безцветни и леко вискозни течности (Фигура 1Б). Представителен 1H NMR на йонната течност mono-HexC10TFSI е показан в Фигура 1С, и заедно с масовата спектрометрия и данните за елементарен анализ потвърдиха структурата.
След това беше определена термичната стабилност на четирите йонни течности (Маса 1). Като представителна йонна течност, di-HexC10TFSI ще бъде описан подробно. Първо се извърши DSC, за да се определи дали има фазови преходи между -70 до 150 ° C (Фигура 2А). Няма температура на преминаване на стъкло При йонен течен di-HexC10TFSI се наблюдава огън или температура на топене, което показва широкия диапазон и стабилността на течната фаза в този температурен диапазон. При изпитване за температурно скачване, използващо TGA при скорост на нагряване 10 ° C/min, йонната течност di-HexC10TFSI не показва загуба на тегло до 300 ° C. Температурата на термично разлагане е определена на 365 ° C (Фигура 2Б).
Електрохимичната стабилност на моно-HexC10TFSI и di-HexC10TFSI йонни течности беше определена при 100 ° C чрез CV с използване на триелектродна Li/Li/платинова конфигурация. (Фигура 3А). CV измерванията са направени при 100 ° C между -0,5 и 6,5 V (спрямо Li +/Li) при скорост на сканиране от 1 mV/s. Йонните течности Mono-HexC10TFSI и di-HexC10TFSI са стабилни до най-малко 5,0 V срещу Li +/Li при 100 ° C. Над 5,0 V се получава разлагане на TFSI аниона.
т. "fo: keep-together.within-page =" 1 "> След това вискозитетите на йонните течности бяха определени при 25 ° C (Маса 1) Тъй като вискозитетите на моно- и ди-HexC10TFSI HexC10TFSI йонни течности са значително по-ниски (7 Pa sec при стайна температура) в сравнение с йонните течности на базата на Cl, останалите изследвания са проведени с тези две течности. Впоследствие LiTFSI се смесва с моно-HexC10TFSI и di-HexC10TFSI, съответно, с тегловно съдържание от 5% (0,3 М) и се измерва вискозитетът и проводимостта на електролитите. При всички температури между 25 и 100 ° C електролитът di-HexC10TFSI + LiTFSI има по-висок вискозитет от моно-HexC10TFSI + LiTFSI. повишена температура, предлагаща по-ниски вискозитети (Фигура 4А). По същия начин стойностите на проводимостта се увеличават при по-високи температури и за двата електролита, като моно-HexC10TFSI + LiTFSI електролитът показва по-високи стойности на проводимост от електролита di-HexC10TFSI + LiTFSI при всякакви температури.
След това зависимостта на вискозитета и йонната проводимост от добавеното количество LiTFSI (0,3 M и 1,6 M) към монолитите He-C10TFSI + LiTFSI и di-HexC10TFSI + LiTFSI се определя като функция от температурата. Както е показано в Фигура 4В, Концентрацията на LiTFSI сол влияе както върху проводимостта, така и върху вискозитета. По-високите концентрации на сол осигуряват по-вискозна смес и следователно по-слабо проводима среда. Повишаването на температурата значително намалява вискозитета и следователно увеличаването на проводимостта за всички състави. Моно-HexC10TFSI + LiTFSI електролитът показва по-нисък вискозитет и по-висока проводимост от съответния електролит di-HexC10TFSI + LiTFSI. Например, при стайна температура моно-HexC10TFSI + LiTFSI електролитът (0,3 M и 1,6 M) показва относително ниска проводимост (
0,01 mS/cm), докато при 100 ° C проводимостта се увеличава с два порядъка и е около 1 mS/cm. По-високите количества LiTFSI дават ниска проводимост и високи вискозитети. Например, когато температурата се повиши до 100 ° C, проводимостта на моно-HexC10TFSI + LiTFSI 0,3 M (
1,7 mS/cm) електролит е почти два пъти стойността, измерена за 1,6 M състав (
Преди експериментите с клетъчни монети бяха проведени CV експерименти за определяне на електрохимичния отговор на моно-HexC10TFSI + LiTFSI (0.3 M) и di-HexC10TFSI + LiTFSI (0.3 M) при 25, 60 и 100 ° C в присъствието на редокс двойката Li/LiCoO 2, съответно (Фигура 3Б). Напрежението беше изметено от 1,5 до 4,6 V със скорост на тока 1 mV/sec. Токът се е увеличил драстично от 25 до 100 ° C, което показва, че с повишаване на температурата вискозитетът намалява с произтичащото понижено вътрешно съпротивление. Моно-HexC10TFSI + LiTFSI показа по-висок токов отговор от di-HexC10TFSI + LiTFSI при всяка температура. Наблюдават се приблизително 3,6 V и 4,1 V очаквани пикове на окислително-редукционни реакции на LiCoO2. Интеркалирането и деинтеркалирането на Li + са предимно пълни от 2,5 V до 4,6 V и не се наблюдава разлагане на очевиден материал в този диапазон.
За по-нататъшно изследване на жизнения цикъл на батериите е извършен експеримент с удължен галваностатичен цикъл на заряд-разряд с тип бутон, съдържащ електролита monoHexC10TFSI + LiTFSI (1,6 M) със скорост на тока C/7, съответстваща на заряд/разряд на капацитетът на катода за 7 часа. Батерията работеше един месец при 100 ° C и цикъл от 70 пъти (Фигура 5D). Високият първоначален капацитет на
135 mAh/g намалява до 70 mAh/g след 70 цикъла.
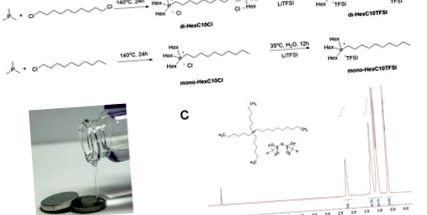
Фигура 1. Синтез и структурна характеристика на фосфониева йонна течност. (ДА СЕ) синтетичният път за йонната течност monoHexC10TFSI; (Б) Снимка на пречистена моно-HexC10TFSI йонна течност; Y. (° С) 1 Н ЯМР спектър за моно-HexC10TFSI. Щракнете тук, за да видите по-голяма версия на тази фигура.
Фигура 2. Данните за характеризиране на термичната стабилност на моно- и ди-HexC10TFSI йонни течности HexC10TFSI. (ДА СЕ) Топлинен поток като функция от температура от -70 до 150 ° C, измерена чрез DSC; Y. (Б) Загуба на тегло като функция от температурата, измерена чрез TGA. Щракнете тук, за да видите по-голяма версия на тази фигура.
Фигура 3. експерименти с циклична волтаметрия. (ДА СЕ) Цикличната волтаметрия на monoHexC10TFSI при 100 спрямо Pt; (Б) Цикличната волтаметрия на di-HexC10TFSI при различни температури в двойката LiCoO2/Li редокс; Y. (° С ) циклична волтаметрия на моно-HexC10TFSI + LiTFSI при различни температури в редокс двойка LiCoO2/Li. Препечатано с разрешение от Ciencias Químicas 27. Щракнете тук, за да видите по-голяма версия на тази фигура.
Фигура 4. Измервания на проводимост и вискозитет. (ДА СЕ) di-HexC10TFSI + LiTFSI (0,3 M) и моно-HexC10TFSI + LiTFSI (0,3 M) като функция от температурата, (Б) моно-HexC10TFSI + LiTFSI, заредени с различни концентрации на LiTFSI като функция от температурата. Препечатано с разрешение от Ciencias Químicas 27. Щракнете тук, за да видите по-голяма версия на тази фигура.
Фигура 5. монети експерименти батерия клетка. (ДА СЕ) Схематично представяне на клетката на бутона; (Б) Капацитет на разреждане като функция от номера на цикъла за батерия, съдържаща моно-Hexc10TFSI + LiTFSI (0,3 M) и di-HexC10TFSI + LiTFSI (0,3 M) при 100 ° C; (° С) Капацитет на разреждане като функция от номера на цикъла за батерия, съдържаща моно-Hexc10TFSI, легирана с различни концентрации на LiTFSI при 100 ° C; (Д) Галваностатичен едноредов батериен заряд-разряд с моно-Hexc10TFSI + LiTFSI (M 1.6) състав при 100 ° C, текуща скорост при C/7. Препечатан с разрешение от 27 Chemical Sciences. Щракнете тук, за да видите още една голяма версия на тази фигура.
Таблица 1. Свойства на йониc Разследвани течности.
a Определете -70 до 150 ° C; показва, че Tg или Tm не са наблюдавани в анализирания температурен диапазон.
b Температура при 10% загуба на тегло. По време на изпитването пробите са защитени с азот.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Дискусия
Нашият подход към разработването на високотемпературни, незапалими функционални литиево-йонни батерии е синтезът на нови йонни течни електролити и тяхната по-нататъшна оценка в прототипични клетки с бутони. По-конкретно, електролитите на базата на моно- и ди-HexC10TFSI HexC10TFSI бяха тествани в тип бутон с Li метален анод и LiCoO 2 катод. Критичните стъпки в рамките на този подход са: 1) идентифициране на оловния електролит съгласно набор от проектни спецификации; 2) поддържайте сухота и се уверете, че водата не попада в клетката; и 3) разработване на процедура за сглобяване на клетки, която осигурява работеща батерия.
Въз основа на изискванията за идеалния електролитен материал, описани по-горе, изборът на електролит може да бъде предизвикателство. Тези изисквания често си противоречат и при компромиси трябва да предприемете стъпки за максимизиране на производителността на батерията. Представително предизвикателство, което открихме, включваше избора на концентрация на литиева сол. Първоначално избрахме 0,3 М като концентрация, която да се използва в батерията, тъй като тя произвежда най-висока проводимост. Всяко повишаване на концентрацията на сол над 0,3 М увеличава вискозитета и проводимостта намалява поради увеличаване на масата. Обаче беше забелязано, че тази ниска концентрация на сол при ограничен цикъл на натоварване-разряд, докато използването на по-високи концентрации, като 1,0 М и 1,6 М (които имаха по-ниски стойности на проводимост), даде цикличността вече стабилна в клетката на монетите. Опитите за увеличаване на концентрацията на Li сол над 1,6 М не бяха успешни, тъй като бяхме на границата на разтворимостта. Освен това, като се използва тази процедура, катодът, анодът и сепараторът, заедно с електролита, могат да се обменят и променят, за да се оценят други конфигурации на батерията.
При правилно боравене с всички материали, за да се осигури сухота, като се покрият напълно всички компоненти на клетката на бутона (например електродът и сепараторите) с електролита и се позволи на клетката на бутона да балансира, може да се произведе тип бутон за батерия, който е подходящ за изпитване на йонни течни електролити при висока температура. Ако възникне неуспех или се получат необичайни резултати, прегледайте предишните стъпки и предложения и повторете експериментите. Ограничения могат да възникнат и поради присъщите свойства на материалите, използвани за изграждане на клетката на бутона. Например, ако тестовете се извършват над 100 ° C, дистанционните елементи и електродите трябва да бъдат сменени.
В заключение, ние описваме протоколи за приготвяне на йонни течности и електролити на фосфониева (трифлуорометан) сулфонимидна сол на основата на литиеви бис и за сглобяване на незапалима и високотемпературна литиево-йонна клетъчна батерия. Измерват се вискозитетът, термичната стабилност, проводимостта и електрохимичната стабилност на йонни течни моно-фосфоний и ди-фосфоний. Приготвянето на монетна клетъчна батерия, съдържаща или LiTFSI монофосфоний + LiTFSI или ди-фосфоний + електролити, и тест след батерията при 100 ° C разкриха влиянието на концентрацията на литиева сол върху успешното колоездене. Тези утвърдени експериментални процедури улесняват изследването на високотемпературни батерии, особено тези, които използват вискозни и безводни електролити.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
- TOURMALINE PRO INTENSE 2200 IONIC сешоар; ОЗОН
- Vpx течен клен; Профил; Форумът „Изкуството да отслабваш да се научиш да ядеш“
- Седмица 16 от бременността - Започвате да забелязвате първите ритници
- Неонатален скрининг за вроден хипотиреоидизъм, анализ на настоящите доказателства и предложени
- Прероден сексуален на всяка възраст Небидо
