1 болница за научни изследвания 12 октомври (i + 12) - Медицински факултет - Университет Комплутенсе в Мадрид (Испания)
От друга страна, честотата на диференциран рак на щитовидната жлеза, експериментален in vivo модел на потискане на хормоните на щитовидната жлеза чрез превантивна терапия на рецидив, се е увеличила значително. Има клинични насоки за неговото управление, но е очевидно, че възможните вторични ефекти, произтичащи от него, изискват точно индикация, коригирана спрямо съотношението риск-полза на дозата на тиреоидните хормони, предписана в дългосрочен план, особено в случаите на нисък тумор агресивност, напреднала възраст и дори при крехки пациенти. Пациентите с висок риск трябва да бъдат насочени за костна денситометрия, за да обмислят лечението на бъдещи фрактури. Предотвратяването на остеопороза, особено при жени в менопауза, е силно желателно и трябва да включва адекватна диета с добавки с калций и витамин D, ако е необходимо. Все още няма консенсус относно лечението на остеопороза при пациент с рак на щитовидната жлеза и потискащо лечение, но критериите, посочени за постменопаузална остеопороза като цяло изглеждат приложими.
Ключови думи диференциран рак на щитовидната жлеза; двойна фотонна денситометрия; костна минерална плътност; резултат на трабекуларна кост; хипертиреоидизъм и субклиничен хипотиреоидизъм; тиреотропен хормон
През последните години е постигнат напредък в регулирането на скелетното развитие и поддържането на костната маса на възрастния от оста хипоталамус-хипофиза-щитовидна жлеза. Проведени са проучвания за ефекта на хормоните на щитовидната жлеза върху остеобластите, остеокласта и хондроцитите. Това изследване е довело до по-добро генетично познаване на физиологията на клетъчното действие на тези хормони. Напоследък се предлагат възможни интервенции на D2 деодиназа при остеопороза. Връзката между минералното достойнство на костите, качеството на костите и риска от фрактури с хормони на щитовидната жлеза при нормални жени в постменопауза предполагат роля на тези хормони, дори в рамките на нормалната щитовидна жлеза, при тези заболявания.
От друга страна, честотата на диференциран рак на щитовидната жлеза, експериментално in vivo потискане на хормоните на щитовидната жлеза чрез терапия, рецидивиращо заболяване, се е увеличила значително. Има ръководства за управление, но е ясно, че вторичните производни изискват прецизно коригирана баланс индикация, съотношение риск-полза на дозата на хормоните на щитовидната жлеза, предписани в дългосрочен план, особено в случаите на ниска туморна агресивност, напреднала възраст и дори при крехки пациенти. Пациентите с висок риск трябва да бъдат насочени за костна денситометрия, за да обмислят лечение на бъдещи фрактури. Предотвратяването на остеопороза, особено при жени в менопауза, е силно желателно и трябва да включва адекватна диета с добавки с калций и витамин D, ако е необходимо. Все още няма консенсус относно лечението на остеопороза при пациент с рак на щитовидната жлеза и супресивно лечение, но посочените критерии за постменопаузална остеопороза изглежда са приложими като цяло.
Ключови думи рак на щитовидната жлеза; двойна фотонна денситометрия; костна минерална плътност; резултат на трабекуларна кост; хипертиреоидизъм и субклиничен хипотиреоидизъм; тиреотрофичен хормон
Тиреоидните хормони (НТ) се намесват в развитието на скелета, в придобиването на пика на костната маса и в поддържането на костното ремоделиране. Клинично-епидемиологичните проучвания показват, че както НТ дефицитът, така и излишъкът са свързани с риск от фрактури, като се има предвид, че еутиреоидизмът е от съществено значение за нормалното функциониране на костното ремоделиране [1].
В тази работа ще разгледаме клетъчните действия на НТ върху костите, и по-специално експерименталния модел in vivo на излишък и потискане на тиреоид стимулиращ хормон (TSH) при пациенти с диференциран карцином на щитовидната жлеза (DTC) при жени преди и след менопаузата. При мъже с CDT няма качествени надлъжни проучвания за техния анализ.
Тиреоидни хормони и кости
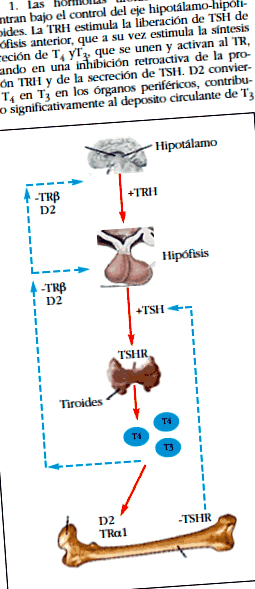
HT и костите са тясно свързани, тъй като HT са ключови регулатори на костното ремоделиране. HT имат основна роля в растежа и развитието на гръбначните животни. НТ са йодотиронини, синтезирани в щитовидната жлеза, чиято постоянна секреция се осигурява от два механизма: 1) секреция на НТ, контролирана чрез обратен механизъм, от оста хипоталамус-хипофиза-щитовидна жлеза (Фигура 1 и Фигура 2) чрез вътреклетъчно активиране, регулирано от Тъканни йодотиронин дейодинази [2].
Фиг2В Т3 би действал индиректно върху остеокласта чрез действие, медиирано от остеобласта, евентуално индуцирайки освобождаването на RANKL и интерлевкини 6 и 8 и на PGE2, в ранните етапи върху прекурсори или благоприятстващо диференциацията на преостеокласта. T3 ще действа благоприятно за диференциацията на остеобласта и фазите на минерализация на матрицата. Възможно е индуцирането на транскрипция на IGF-1 и неговите протеинови транспортери и други фактори да стимулира пролиферацията и диференциацията на остеобласта. Наличието на TRО ± 1 и TRОІ1 в хондроцитите в тази клетъчна линия позволява на Т3 да стимулира нейното съзряване и следователно ендохондралния процес на осификация. (Променено от Wojcika et al. 4) В
Рецептори за HT
Тези три функционални рецептора за НТ (TRО ± 1, TRОІ1 и TRОІ2) са кодирани от гените THRО ± и THRОІ, които регулират тяхната експресия и транскрипционни отговори към TRs. В костите е описана експресията на TRО ± 1 и TRОІ1, като първата е в преобладаващи концентрации 10: 1. Следователно TRО ± се счита за основен медиатор на действието на Т3 върху костите [6].
HT, TSH и костно развитие
Както TRО ± 1, така и TRОІ1 рецепторите се експресират върху хондроцитите на растежната плоча, което предполага, че те са цели за действие на Т3. Пролиферацията и диференциацията на хондроцитите се контролира от индийски таралеж, PTHrp, BMP-R1A, IGF1, Wnt и FGF. Първите три чрез отрицателна обратна връзка, която предизвиква растежа на плаката и инхибира диференциацията й, като контролира нейния линеен растеж. HTs се намесват в този регламент, чувствителен към наличието на T3, който стимулира експресията на гени за синтеза на хрущялен матрикс и последващата му минерализация.
Наскоро е описана хетерозиготна мутация в гена THRО ± при 6-годишно момиче, което въпреки че има НТ в ниската или нормалната граница и нормален TSH, има забавяне на растежа и хистологично засягане на костите, подобно на хипотиреоидизъм, което предполага важно роля на тези TRО ± рецептори в развитието на костите на човека [10].
HT и TSH във връзка с минералната плътност на костите и фрактурите в нормална популация
Анамнезата за хипертиреоидизъм изглежда е рисков фактор. В проучването SOF (Изследване на остеопоротични фрактури), проведено при 192 жени в напреднала възраст с проследяване от 4,1 години, най-високата честота на остеопоротични фрактури е регистрирана при пациенти с анамнеза за фрактури и/или хипертиреоидизъм [петнадесет]. В това проучване не са намерени доказателства за свързване на ниски нива на TSH с ниска BMD. Авторите заключават, че хипертиреоидизмът може или не може да намали костната маса, но че в тяхното проучване намаляването на КМП не е отговорно за силната връзка между предишен хипертиреоидизъм и риска от фрактура на тазобедрената става.
HT и TSH: връзка с костната минерална плътност и фрактури при жени с дисфункция на щитовидната жлеза
В обобщение, публикуваните данни показват, че за да се докаже ясна причинно-следствена връзка, са необходими рандомизирани и контролирани проучвания със значителен брой пациенти и за да се оцени дали нормализирането на нивата на TSH при субклиничен хипертиреоидизъм е свързано с риска от фрактура. Данните показват, че субклиничният хипертиреоидизъм е свързан с повишен риск от фрактури на тазобедрената става и невертебралната област, но трябва да се анализират други фактори и да се проведат по-качествени проучвания.
НТ и костна трабекуларна микроархитектура
Критерии за потискане на TSH при диференциран рак на щитовидната жлеза
Диференцираният карцином на щитовидната жлеза (DTC) е най-честата ендокринна неоплазия (тя представлява 1% от всички видове рак). 85-90% от раковите заболявания на щитовидната жлеза са CDT, което включва два варианта, папиларен карцином (най-често срещаният) и фоликуларен. Честотата му се увеличава през последните 10 години, но смъртността му остава същата [29]. Това увеличение се дължи до голяма степен на увеличаването и подобряването на разделителната способност на диагностичните тестове, с по-голямо откриване на случайни микрокарциноми.
Tab1В TSH цели за дългосрочна терапия с щитовидната жлеза при диференциран карцином на щитовидната жлеза. Според Haugen BR et al. 32В
Забележка2tab1 ** Целта на TSH за пациенти с непълен биохимичен отговор може да варира в зависимост от първоначалния ATA риск, нивата на Tg, тенденцията на Tg във времето и риска от потискане.
Въпреки че няма общ консенсус относно оптималните нива на TSH за намаляване на рецидивите и докато минимизират неблагоприятните ефекти на субклиничния хипертиреоидизъм, Американската асоциация на щитовидната жлеза (ATA) наскоро определи въздействието на супресията на TSH при пациенти с CDT. Характеризиращо се с ниско, средно и високо риск от рецидив, като се вземат предвид различни клинични фактори [32].
Tab2В Списък на надлъжните проучвания за ефекта на потискане на TSH с левотироксин върху костната минерална плътност (КМП) при жени преди и след менопауза с рак на щитовидната жлеза В
Супресивно лечение с НТ при диференциран рак на щитовидната жлеза и костите. Надлъжен vs. напречни сечения
второто разгледано надлъжно проучване е на Mulller et al. [57] Те проучиха 15 жени преди менопаузата и 10 жени след менопауза на супресивно лечение с Т4 за променлив период от 1,5 години. От тази група те завършиха с 24 пациенти с DTC, преоценени с DXA с интервал за проследяване от 1,5 ± 0,5 години. Те избраха 15 контролни субекта, съвпадащи по пол, менопаузален статус, възраст и ИТМ. Те стигнаха до заключението, че потискането на TSH е придружено от незначителни намаления (2-5%) в лумбалната КМП и КМП на шийката на бедрената кост, без инцидентни фрактури. Установеното намаление на BMD е по-ниско от класическото, описано от Mazess, при което повишеният риск от фрактура на гръбначния стълб се увеличава 1,5-2 пъти за всяко стандартно отклонение (SD), което BMD намалява [58], което предполага липса на ефект на това ниво.
В нашия опит [55], ние проучихме 14 жени преди менопаузата и 13 жени след менопаузата с CDT и TSH супресия, последвани в нашата служба след тяхната тотална тиреоидектомия с повтаряща се двойна фотонна денситометрия в продължение на две години. 50% от нашите пациенти са показали TSH под 0,1 mIU/L. Дозата LT4 показва положителна прогнозна стойност при всяко изследвано костно място, което едва е било описано. Нито един от изследваните костни и минерални параметри не корелира с костната маса, с изключение на алкалната фосфатаза на нивото на триъгълника на Уорд и ултрадисталния радиус. Това е в съответствие с нормалните стойности на КМП и ремоделиране на костите, установени при тези пациенти с продължително супресивно лечение. Потиснатите пациенти показват слабо намаление на КМП в дисталната 1/3 от радиуса (Z-резултат = -0,77 В ± 0,98; 95 CI: -1,11; -0,44), без разлики между преди и след менопаузата.
В селективна и доста голяма група пациенти в постменопауза с папиларен CDT, Sugitani et al. [63] анализира ефекта, който постоперативната TSH супресивна терапия предизвиква върху преживяемостта без болести и нейните ефекти върху КМП. Те анализираха две групи: 140 пациенти с потискане (средно TSH: 0,07 ± 0,10 mIU/L и 127 без потискане (средно TSH: 3,14 ± 1,60 mIU/L). От непотиснатата група 120 пациенти в постменопауза последвано в продължение на 5 години, показващо намаляване на лумбалната КМП в подгрупата на жени в постменопауза с възраст над 50 години. Повечето от техните пациенти са били с нисък риск. В крайна сметка те препоръчват потискане на TSH, особено при пациенти с нисък риск и при възрастни хора пациенти, не трябва да се посочват, като се вземе предвид, че не е доказано, че намалява рецидивите дори при високорискови пациенти.
Надлъжното проучване на Karner et al. [64] е проведено при жени в пременопауза с CDT в продължение на една година. Продължителността на потискането на TSH в началото на проучването е била 9,4 ± 6,4 години и следователно дълга. Измерванията на КМП се извършват два пъти за период от една година. Използвайки SPA (единична фотонна абсорбциометрия) за крайници и DXA, те не откриват намаляване на КМП на нивото на дисталния радиус, нито на КС на лумбалната и/или тазобедрената става. Това е надлъжно проучване с кратка продължителност, малък брой участници (19 в пременопауза). Основната му препоръка е да се извърши изследване на костна денситометрия преди започване на супресивно лечение с TSH, за да се идентифицират пациенти с висок риск от остеопороза.
Рискови фактори при пациенти с CDT и TSH супресивно лечение
- След 25 години затлъстяването ще причини повече рак, отколкото цигарите при жените
- Експертите посочват, че затлъстяването е свързано с диференциран тип рак на щитовидната жлеза
- Хистеректомията е опция за жени със затлъстяване с рак на матката Diario Público
- Ефективността на хормоналното лечение при жени в менопауза с рак на гърдата зависи от теглото
- Затлъстяването удвоява риска от рак на дебелото черво при жените CuidatePlus