Обобщение
Достъпът е предоставен от
Въведение
Изображение в пълен размер
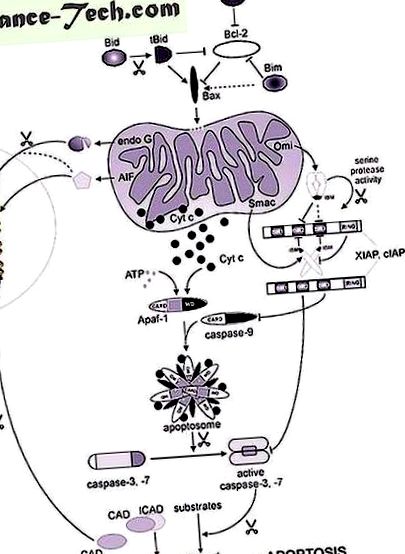
Първо, ние описваме цитохром с, първият митохондриален протеин, който се отделя от митохондриите при апоптотични условия. Цитохром с генерира каспазна каскада чрез насърчаване на образуването на апоптозома, стига да е експресиран апоптотичен протеазен активационен фактор 1 (Apaf-1). След това се фокусираме върху ендонуклеаза G и фактор, индуциращ апоптоза (AIF), които и двете допринасят за разграждането на ядрената ДНК. Приносът му за апоптотичното увреждане на ДНК се обсъжда в контекста на съществуването на други немитохондриални нуклеази, които са активни в хода на апоптотичната клетъчна смърт. Освен цитохром с, други митохондриални фактори като Smac/DIABLO и HtrA2/OMI също могат да допринесат за активирането на каспаза, или косвено. Smac/DIABLO и HtrA2/OMI противодействат на инхибитора на апоптозни протеини (IAP), семейство клетъчни инхибитори на каспаза. Въпреки това, Smac и HtrA2/OMI също причиняват каспаза-независима клетъчна смърт чрез все още неизвестни механизми.
Цитохром c
Митохондриални медиатори на ядрена хроматинова кондензация и фрагментация на ДНК.
Ендонуклеаза G
Фактор, предизвикващ апоптоза
Освобождаването на съответните AIF хомолози от митохондриите и тяхното преместване в ядрото се запазва в Dictyostelium discoideum и нематода C. elegans (Arnoult et al., 2001; Wang et al., 2002). Трябва да се отбележи, че регулирането на експресията на WAH-1, ортологът на нематодите на AIF, забавя само програмираната смърт на нематодни клетки (PCD). Не е ясно дали AIF взаимодейства и стимулира активността на ендонуклеаза G при бозайници, какъвто е случаят с неговите аналози на C. elegans. .
Свързаният с митохондриите индуктор на клетъчна смърт, хомоложен на AIF (AMID) и р53-чувствителен ген 3 (PRG3), са свързани с AIF (Ohiro et al., 2002; Wu et al., 2002). AMID е AIF хомоложен флавопротеин, за който се предполага, че е свързан с WMO. Свръхекспресията на AMID в 293T клетки предизвиква апоптотична клетъчна смърт, която не може да бъде инхибирана от Bcl-2, CrmA или zVAD-fmk. PRG3 се намира в цитоплазмата и предполагаемата му оксидоредуктазна активност е необходима поради своята апоптотична функция. Молекулярният механизъм на действие на AMID или PRG3-индуцирана клетъчна смърт е неясен.
Каспаза-зависимо освобождаване на AIF, действащо независимо от каспаза и ендонуклеаза G?
Smac/DIABLO и HtrA2/OMI: повече от просто антагонисти на IAP
Таблица в пълен размер
$ config [ads_text16] не е намерен
Изображение в пълен размер
Smac/DIABLO
Механизмът, чрез който Smac/DIABLO се свързва с BIR2 домейна на XIAP, е неясен, въпреки че изисква IBM и димерния Smac/DIABLO (Wu et al., 2000; Chai et al., 2001). За разлика от това, взаимодействието на активна каспаза-3 и -7 с BIR2 домейна на XIAP не включва свободен N-терминал или IBM. Как Smac/DIABLO може да облекчи инхибирането на каспаза-3 и -7, медиирано от XIAP? Отговорът изглежда се крие в димерната структура и следователно бивалентната природа на Smac/DIABLO и наличието на множество BIR домейни в XIAP. Използвайки in vitro каспазна активност и тестове за свързване, Huang et al. (2003) наскоро показа, че Smac/DIABLO взаимодейства като димер с молекула XIAP, като едновременно свързва BIR2 и BIR3 домейните. Това взаимодействие се случва с субнаномоларната дисоциационна константа (K D), докато взаимодействието на Smac/DIABLO с BIR2 или BIR3 домейна на XIAP се случва индивидуално с микромоларен KD. Това е добър пример за авидност, силата на свързване между две молекули, определена от две или повече места за взаимодействие. Този силен афинитет към XIAP позволява на Smac/DIABLO да измести каспаза-7 (и каспаза-9) от XIAP in vitro, улеснявайки тяхното активиране.
IAPs обаче могат да се борят със Smac/DIABLO, за да поддържат антиапоптотично състояние в клетката. Съобщава се, че RING домейнът, присъстващ в XIAP, cIAP1 и cIAP2, притежава убиквитин-протеинова лигазна активност и може да допринесе за антиапоптотичната функция на IAPs чрез насочване на Smac/DIABLO за протеазомно медиирано разграждане (MacFarlane et al., 2002; Hu и Янг, 2003). Въпреки това, в тимоцитите тази активност действа срещу IAPs, тъй като е установено, че cIAP1 и XIAP се самоубиквитират и разграждат в отговор на лечение с глюкокортикоиди или етопозид (Yang et al., 2000). Smac3, сплайс вариант на Smac, който също е насочен към митохондриите, съдържа IBM и се освобождава в цитозола в отговор на апоптотични стимули, наскоро доказано, че се свързва с XIAP и насърчава убиквитинацията на XIAP (Fu et al., 2003).
В противоречие с този елегантен Smac/DIABLO-IAP, антагонизмът е проапоптотичната природа на Smac β, вариант на сплайсинг на Smac, който няма митохондриална насочваща последователност и не свързва IAP, но сенсибилизира индуцираната от лиганд апоптоза на смъртта. и химични стимули (Roberts et al., 2001). Проапоптотичната функция на Smac β се осъществява от неговия С-краен домейн. Физиологичната митохондриална функция на Smac/DIABLO е неизвестна, а мишките Diablo -/- очевидно са нормални. Въпреки че Diablo -/- клетъчните лизати не показват обработка на каспаза-3 след добавяне на цитохром с, мишките и Diablo -/- клетките реагират нормално на апоптотични стимули (Okada et al., 2002). Това наблюдение предполага съществуването на излишни фактори, които компенсират загубата на Smac/DIABLO, вероятно HtrA2/OMI (виж по-долу) или че Smac/DIABLO не играе съществена и обща роля в апоптозата по време на развитието.
HtrA2/IMO
Ядрено кодираният HtrA2/OMI се изразява като 50 kDa предшественик протеин, притежаващ N-краен MLS, който се отстранява при митохондриален импорт, последван от втора водеща последователност, съдържаща трансмембранен домен. Обработката на този втори лидер, която се случва в субпопулация на групата HtrA2/OMI, излага IBM и генерира зрял HtrA2/OMI от 35 kDa (Suzuki et al., 2001a; Hegde et al., 2002; Martins et al., 2002; van Loo et al., 2002b; Verhagen et al., 2002). Тъй като каталитично неактивният HtrA2/OMI в mnd2 мишки се обработва правилно, узряването на HtrA2/OMI вероятно се катализира от други митохондриални протеази (Jones et al., 2003).
Въпреки че мишките с дефицит на HtrA2/OMI все още не са налични, при експериментите с RNAi се предполага принос на HtrA2/OMI към апоптозата, тъй като клетъчната смърт, индуцирана от Fas, TRAIL, ставроспорин или UV, значително намалява (Hegde et al., 2002; Martins et al., 2002). За разлика от това, фенотипът mnd2, приписван на нарушена каталитична активност на HtrA2/OMI, се характеризира с повишена чувствителност към апоптотични тригери (Jones et al., 2003). Тъй като регулирането надолу на експресията или нивата на активност на HtrA2/OMI ще повлияе както на нейната митохондриална функция, така и на цитозолната му роля в клетъчната смърт, невъзможно е да се направят твърди заключения относно точния принос на HtrA2/OMI към смъртта. не могат да бъдат куплирани, например чрез мутационна намеса.
Други митохондриални фактори
Заключения
Израз на благодарност
Благодарим на Амин Бредан за редакционната му помощ. Тази работа беше подкрепена от Interuniversitaire Attractiepolen (IUAP-V), Fonds voor Wetenschappelijk Onderzoek-Vlaanderen (безвъзмездни средства 31.5189.00 и 3G.0006.01) и EC-RTD (Grant QLRT-CT-1999-00739), Гентски университет. съфинансиране на проекта на ЕС (011C0300) и проекта GOA (12050502). X Saelens е подкрепен от „Биотехнологични фондове“ и проекта GOA (12050502), L Vande Walle и N Festjens с безвъзмездна финансова помощ от IWT, M van Gurp от безвъзмездна помощ от „Centrum voor Gezwelziekten“, G van Loo е изплатен от El IUAP-V.
- Осемте най-добри протеинови и хидратиращи шейка от 2021 г. - Протеинови шейкове
- Най-добър протеинов шейк 2021 г. Сравнение на 7-те най-добри
- Седемте най-добри чисти суроватъчни протеинови шейка от 2021 г. - протеинови шейкове
- Протеини за вегетарианци Пълен списък 【2021】
- Осемте най-добри плодови и протеинови шейкове от 2021 г. - Протеинови шейкове