- Обобщение
- Въведение
- Резултати
- Изчерпването на Lin-9 в клетки от миши ембрионален карцином разкрива митотичен дефект
- Lin-9 е необходим за транскрипция на G 2/M ген
- Lin-9 се свързва с B-Myb, но не и с джобни протеини в F9 клетки
- F9 клетките съдържат LINC-подобен комплекс, съдържащ B-Myb и Lin-9
- Lin-9 и B-Myb се свързват и активират промоторите на G 2/M гените
- Специфичните места за свързване на промотора Survivin са от съществено значение за свързването на Lin-9 и B-Myb
- Дискусия
- Конфликт на интереси
- Допълнителна информация
- Файлове с изображения
- Допълнителна фигура S1
- Допълнителна фигура S2
- Допълнителна фигура S3
- Word документи
- Допълнителни фигури Легенда
- Допълнителни материали и методи
- Excel файлове
- Допълнителна информация
Обобщение
Въведение
В това проучване ние изследвахме взаимодействието Lin-9/B-Myb в клетки от миши ембрионален карцином (СЕ) на мишки F9, които за разлика от клетките, изследвани по-рано, се регулират само при прехода G 2/M. В клетките F9 Както при миши ембрионални стволови клетки (ES) (White et al., 2005), Rb, p107 и p130 джобните протеини се поддържат в хиперфосфорилирано състояние. Следователно, няма репресивни комплекси E2F и липса на регулация на клетъчния цикъл в G 1/S. Ние показваме, че потискането на експресията на Lin-9 чрез интерференция с РНК причинява арест в митоза и ние използваме тази система за откриване на Lin-9 транскрипционни цели . По-късно беше показано, че Lin-9 и B-Myb си сътрудничат като транскрипционни активатори на ключови G2/M гени. И накрая, идентифицирахме комплекс B-Myb в клетки F9, който съдържа повечето от компонентите, идентифицирани преди това в LINC. Показателно е, че недиференцирана връзка между джобните протеини и LINC не е открита в недиференцирани F9 клетки, което показва, че клетъчният цикъл се регулира от комплекс B-Myb/LINC само в прехода G 2/M.
Резултати
Изчерпването на Lin-9 в клетки от миши ембрионален карцином разкрива митотичен дефект
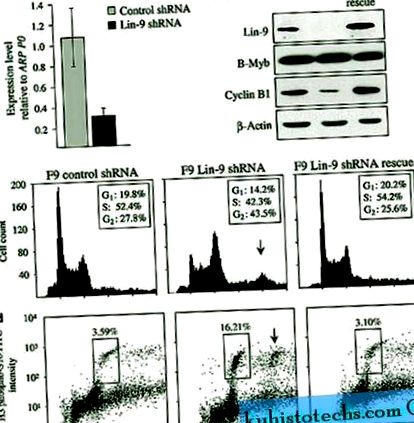
Lin-9 се изчерпва от F9 клетки чрез трансфекция на pSuper вектори, кодиращи къса шпилка РНК (shRNA), насочена срещу миша Lin-9. Контролните клетки бяха трансфектирани с pSuper, експресиращ луцифераза shRNA pGL3. Количествената PCR (qPCR) демонстрира, че Lin-9 shRNA значително намалява експресията на Lin-9 със 71% (P
Изчерпването на Lin-9 в клетки от ембрионален карцином на F9 разкрива митотичен дефект. ( да се ) Количествен RT-PCR анализ на експресията на Lin-9 в изчерпани Lin-9 клетки спрямо контролните клетки. Експресията се нормализира до рибозомния ARPP0. ( б ) Western blot анализ на Lin-9, B-Myb и Cyclin B1 в F9 клетки, трансфектирани с shRNA GL3 (контрол), shRNA Lin-9 (Lin-9) и shRNA Lin-9 с резистентни към shRNA pCAGGS-Lin - 9R вектор (спасяване). За контрол на натоварването се използва control-актин. ( ° С ) Проточен цитометричен анализ (FACS) на клетки, изчерпани от Lin-9, контрол и спасяване, оцветени с пропидиев йодид (PI). Стрелката показва клетки с 8n съдържание на ДНК. ( д ) FACS анализ на изчерпани Lin-9 спасителни и контролни клетки, оцветени с антихистон H3 (фосфо S10) -FITC и оцветени с PI. Клетките в митоза се поставят в кутия и митотичният индекс се показва като процент от клетките. Стрелката показва клетки, съдържащи 8n ДНК, подложени на митоза.
Изображение в пълен размер
За да се определи дали изчерпаните с Lin-9 клетки се натрупват в G 2 или митоза, клетките се анализират чрез FACS и конфокална микроскопия. За определяне на митотичния индекс се извършва FACS с клетки, оцветени с антитяло към хистон Н3 фосфосерин 10 (Н3 фосфоС10), маркер на митоза (Paulson and Taylor, 1982). Изчерпаните Lin-9 клетки показаха повишена митотична скорост (16,21%) в сравнение с контролните клетки (3,59%) и спасителните клетки (3,10%; Фигура 1г). Допълнителна популация от клетки, съдържащи 8n ДНК, се наблюдава при изчерпване на Lin-9 и тези клетки се оцветяват положително за H3 phosphoS10, което показва, че те са в митоза. Конфокалната микроскопия на клетки, оцветени с β-тубулиново антитяло и DAPI, показва по-висок митотичен индекс (14,42%) в клетки с изчерпване на Lin-9 в сравнение с контролни (3,38%) и спасителни (3,07%) клетки; Допълнителна фигура S2). Изчерпаните клетки на Lin-9 съдържат уникални ядра и образуват биполярно вретено по време на митоза, което показва, че натрупването на 4n и 8n клетки се дължи на неуспех на митозата, а не на неправилно образуване на вретено или неуспех на цитокинезата.
Lin-9 е необходим за транскрипция на G 2/M ген
Lin-9 е необходим за регулиране на G 2/M гени в ембрионални стволови клетки. ( да се ) Таблица на G 2/M гени, регулирани надолу в изчерпани Lin-9 F9 ембрионални клетки, както е определено чрез cDNA анализ на микрочипове. Експресионните нива на Lin-9 бяха намалени в изчерпани F9 клетки на Lin-9. ( б ) Количествен RT-PCR анализ на Lin-9 целеви гени в изчерпани Lin-9 клетки спрямо контролни клетки за проверка на данни от микрочипове. Изразът се нормализира на ARRP0 .
Изображение в пълен размер
Регулирането надолу на няколко G2/M гени в изчерпани Lin-9 клетки беше независимо потвърдено чрез qPCR (Фигура 2b). Показателно е, че експресията на регулирани гени в другите етапи на клетъчния цикъл не намалява; Циклин Е2, който е необходим за прехода G1/S, беше регулиран нагоре, докато B-Myb, чиято експресия достигна своя връх по време на S фаза, не беше засегната (Фигура 2b). Интересното е, че експресията на Cyclin A2 и Cdc2 не е била значително модифицирана чрез изчерпване на Lin-9 във F9 клетки, въпреки че предишни проучвания в клетки на възрастни показват транскрипционна зависимост от Lin-9 (Osterloh et al., 2006). Установено е, че B-Myb е необходим за отстраняване на репресивен комплекс E2F4 в промотора на Cdc2 (Zhu et al., 2004) и вероятно липсата на този репресор в клетки F9 прави тази дейност излишна. В обобщение, нашите резултати показват, че Lin-9 е необходим за транскрипционно активиране на специфичен набор от ключови гени, участващи във фазовия преход на G 2/M и по време на митоза.
Lin-9 се свързва с B-Myb, но не и с джобни протеини в F9 клетки
Предишни проучвания показват, че Lin-9 комплекси с B-Myb или джобните протеини p107/p130 на различни етапи от клетъчния цикъл (Schmit et al., 2007; Pilkinton et al., 2007a). Използвайки имунопреципитация и Western blot, беше очевидно, че B-Myb се утаява съвместно с Lin-9 от F9 клетъчни екстракти, но p107 не е, въпреки експресията му в тези клетки (Фигура 3а). Подобни проучвания бяха проведени и за p130; установено е обаче, че p130 не се експресира при нормални условия на растеж в F9 клетки (данните не са показани). В съответствие с предишни проучвания, контролните експерименти показаха, че B-Myb и p107 могат да бъдат утаени съвместно с Lin-9 от екстракти от клетки на мишка NIH3T3 (Фигура 3а). По този начин, за разлика от клетките с установена контролна точка за клетъчен цикъл G 1/S, Lin-9 не се комплексира с джобни протеини в недиференцирани F9 клетки, но все пак може да взаимодейства с B-Myb.
Lin-9 се свързва с B-Myb, но не и с p107 или p130 в недиференцирани F9 клетки. ( да се ) Ядрените лизати на F9 и NIH3T3 клетки бяха имунопреципитирани с преимунни Lin-9 заешки серум (Con), B-Myb, Lin-9 и p107 антитела и Western blot за B-Myb и p107. Контролът за влизане (In) включва 10% от лизатите, използвани за имунопреципитация (IP). ( б ) Ядрените лизати на недиференцирани (F9) и диференцирани F9 (Dif. F9) клетки бяха Western blot за Gata-4 маркера за диференциация и контрола на натоварването с β-актин. ( ° С ) Ядрените лизати на диференцирани F9 клетки бяха имунопреципитирани с преимунен серум (Con), B-Myb, Lin-9 и p107 антитела и Western blotted за B-Myb, p107 и p130. Контролът за влизане (In) включва 10% от лизатите, използвани за IP.
Изображение в пълен размер
Липсата на взаимодействие Lin-9/p107 в F9 клетки (Фигура 3а) може да е резултат от наличието на конститутивно активни циклинови A/E кинази, които инактивират функциите на джобния протеин. За да се тества това схващане, F9 клетки се посяват при условия, които индуцират диференциация на ендодерма; маркерът за диференциация Gata-4 е лесно идентифициран в тези клетки, но не и в нетретираните F9 клетки (Фигура 3Ь). Нивата на B-Myb и p107 намаляват с диференциация, докато, напротив, експресията на p130 се активира (Фигура 3в). Показателно е, че F9 клетъчната диференциация индуцира взаимодействие между Lin-9 и p107 и p130; Установеното остатъчно взаимодействие B-Myb/Lin-9 може да отразява непълна диференциация (Фигура 3в). Ясно е, че джобните протеини могат да се комплексират само с Lin-9, когато F9 клетките се диференцират.
F9 клетките съдържат LINC-подобен комплекс, съдържащ B-Myb и Lin-9
За да се тества дали другите компоненти на LINC са необходими заедно с Lin-9 и B-Myb за митоза в F9 клетки, експресията на Lin-54, Lin-37, Lin-52 или RbAp48 е намалена с помощта на специфични shRNAs. qPCR беше извършен върху РНК, извлечена от клетки, трансфектирани с shRNA и успешното елиминиране на Lin-54 (72%), Lin-37 (94%), Lin-52 (66%) и RbAp48 (94%) (P
Изображение в пълен размер
Тъй като Lin-37 и Lin-52 изглеждат неразделни компоненти на комплекса B-Myb/LINC в недиференцирани F9 клетки, беше съвсем неочаквано, че shRNAs, насочени към тези гени, нямаха очевидни ефекти върху клетъчния цикъл (Фигура 4b). За да се гарантира, че тези протеини са достатъчно изчерпани от РНК интерференция, LINC комплекси от F9 клетки, трансфектирани с контролни Lin-54, Lin-37, Lin 52 и Lin-37 shRNA, са имунопреципитирани и B-Myb чрез Western трансфер. Този експеримент ясно демонстрира, че сродни shRNAs изчерпват Lin-54, Lin-37 и Lin-52 от комплекси с B-Myb в много значителна степен, докато комплекси с RbAp48 не са открити както преди (Фигура 4д). Резултатите показват, че Lin-9, Lin-54 и B-Myb са критични за митозата, докато Lin-37 и Lin-52 не са от съществено значение за тази функция.
Lin-9 и B-Myb се свързват и активират промоторите на G 2/M гените
За да определи дали Lin-9 и B-Myb взаимодействат функционално в транскрипционната регулация на специфични G 2/M гени, ChIP оценява свързването на тези протеини с промоторите на гените Cyclin B1 и Survivin. B-Myb и Lin-9 се визуализират в тези промотори по този начин (Фигура 5а) и се извършва qPCR, за да се определи количествено тяхното обогатяване като процент на входящия хроматин (Фигури 5b и 5c). Както в промоторите на Cyclin B1, така и в Survivin, B-Myb и Lin-9 са значително обогатени (P
Изображение в пълен размер
За да се изследва дали Lin-9 и B-Myb съвместно трансактивират промоторите на Cyclin B1 и Survivin, F9 клетките са ко-трансфектирани с луциферазни репортерни плазмиди, съдържащи промотора на Cyclin B1 или Survivin и pSuper векторите, кодиращи Lin-9 или B shRNA. Моето б. Изчерпването на Lin-9 или B-Myb от F9 клетки значително намалява активността на промотора на Cyclin B1 в сравнение с клетките, трансфектирани с контролна shRNA (P
Изображение в пълен размер
За да се определи дали свързването на B-Myb и/или Lin-9 с промотора на Survivin е зависимо от MBS, се извършват преходни ChIP анализи (Lavrrar и Farnham, 2004) върху F9 клетки, трансфектирани с WT и мутирали репортери. За да се направи разлика между ендогенни и репортерни промотори, една от всяка двойка qPCR праймери е проектирана да се отгрява до гръбнака на pGL2-основния вектор или само до ендогенния промотор на Survivin. Контролните експерименти показаха, че свързването на B-Myb с ендогенния промотор на Survivin не е повлияно значително от преходния анализ на ChIP (допълнителна фигура S3b), въпреки че известен шум (∼ двойно) се наблюдава при свързване на Lin-9 доста по-ниско, но тази вариация е значително по-ниска от тази, наблюдавана при трансфектираните промотори (Фигура 6г). Ефективността на трансфекцията е сравнима за всеки репортер (допълнителна фигура S3c). Нивата на свързване на Lin-9 бяха значително намалени за всяка MBS мутация в сравнение с WT промотора (P
- Храни за активиране на метаболизма
- Ясноклетъчен бъбречен карцином Анализ на честотата и оцеляването в здравна област на
- Мезенхимни стволови клетки в идеи за затлъстяване за транслационни приложения - изследвания от
- Хранене, за да образовате гените си - списание Woman
- Прекъсващо гладуване и сиртуин ключовете за активиране на подмладяващия ген - Uppers