Обобщение
Този протокол описва нов метод за доставяне на вируса до мишата простата. Използвайки технология CRISPR/Cas9, свръхекспресия на гени или доставка на рекомбиназа Cre, техниката позволява ортотопична промяна на генната експресия и прилага нов модел на мишка за рак на простатата.
Резюме
С нарастващата честота на рак на простатата, определянето на нови туморни драйвери или модулатори е от решаващо значение. Генетично модифицираните модели на мишки (GEMM) за рак на простатата са затруднени от хетерогенността на тумора и неговата сложна динамика на микроеволюция. Традиционните миши модели на рак на простатата включват, но не се ограничават до, зародишна линия и условни нокаути, трансгенна експресия на онкогени и ксенографт модели. Генерирането на de novo мутации в тези модели е сложно, отнема много време и е скъпо. Освен това повечето традиционни модели са насочени към по-голямата част от простатния епител, докато човешкият рак на простатата е добре известен, че се развива като изолирано събитие само в малка подгрупа от клетки. Ценните модели трябва да симулират не само започване на рак на простатата, но и прогресия към напреднало заболяване.
Тук ние описваме метод за атака на някои клетки в епитела на простатата, преобразуващите клетки на вирусни частици. Доставката на вирус, насочен към мишата простата, позволява промяна на генната експресия в епитела на простатата. Количеството и видът на вируса по този начин ще определят броя на специфичните клетки за генетична промяна чрез трансдукция на някои клетки за иницииране на рак и много клетки за генна терапия. Чрез инжектиране, базирано на операция, в предния, дисталния лоб на пикочните пътища, туморът в този модел може да се разшири, без да нарушава уринарната функция на животното. Освен това, насочвайки само към подгрупа от простатни епителни клетки, техниката позволява клонално разширяване на тумора и по този начин имитира човешко започване на тумор, прогресия, както и инвазия през базалната мембрана.
Тази нова техника предлага мощен модел на рак на простатата с по-голямо физиологично значение. Страданието на животните е ограничено и тъй като не се изисква допълнително развъждане, общият брой на животните се намалява. В същото време беше ускорен анализът на новите гени и пътища-кандидати, което от своя страна е по-рентабилно.
Въведение
Откриването и лечението на рак на простатата се подобриха значително през последното десетилетие. И все пак честотата на рака на простатата се увеличава поради продължителността на живота. С приблизително 1,1 милиона нови случая в световен мащаб, това е една от най-честите причини за смърт, свързана с рак при мъжете 1. Ракът на простатата се развива бавно, но когато ракът е преминал в напреднало метастатично състояние, прогнозата е лоша поради ограничените възможности за лечение. Досега само няколко гена са идентифицирани като често срещани двигатели на този рак и тяхната хетерогенност и мултифокалност изключват откриването на биомаркери и насочени към насочване болести 2, 3 .
Класическите техники за генериране на GEMM често се влошават поради тяхната сложност, времеви и разходи. Условните модели са широко използвани за изследване на гени-кандидати за рак на простатата, които водят до ембрионална смъртност при инактивиране в зародишната линия 4. По-често срещаните модели включват специфична Cre рекомбиназа на простатата, задвижвана или от модифициран пробазин 5 или PSA 6 промотор, интегриран в GEMM чрез допълнително кръстосване. В тези модели генът, който представлява интерес, ще бъде насочен в повечето клетки на простатния епител, генерирайки хиперплазия в целия орган, която може да наруши функцията на пикочните пътища 7 на животното .
Вирусната доставка на Cre протеин чрез инжектиране в предния лоб на мишата простата може да реши този проблем, като насочи само няколко клетки 8. Вземайки предвид, методът се възползва от широк спектър от вариации на възможни технически изисквания на лабораториите, знания и цели. Успешни подходи с използване на Adenovirus за JunB и Pten 9 или Lentivirus за Pten и Trp53 10 са демонстрирани наред с други. Добавянето на трансгени, като луцифераза, вирусната конструкция или GEMM, също ще позволи неинвазивно проследяване на прогресията на заболяването чрез изображения на биолуминесценция 11 .
Редактирането на генома, базирано на технологията CRISPR/Cas9, разкрива нова и бърза възможност за изследване на рака чрез бързото генериране на соматични нокаути 12. Вирусното доставяне на единични водещи РНК (sgRNAs), насочени към предния лоб на мишата простата, установява по-подходящ физиологичен модел на рак на простатата. По този начин клетките с поискани мутации могат да образуват клонинги, способни на експанзия и инвазия. В допълнение, използването на насочващи РНК за различни целеви гени ще генерира клетъчни клонинги с промени в различни гени. Това ще позволи хетерогенност на тумора и естествен селекционен натиск върху прогресията на рака, което може да разкрие важността на всяка промяна на гени или епистатични механизми.
Тук представяме метод за доставяне на вирусни частици до мишата простата за промяна на генната експресия. Чрез малък коремен разрез се разкрива мишият преден лоб на простатата и в него се инжектират вирусни частици. Пет дни след операцията хирургичните скоби могат да бъдат отстранени от кожата и ракът на простатата може да бъде анализиран от 8 седмици по-късно. Като цяло това е бърза и ефективна процедура, която има малко въздействие върху мишката и позволява увеличаване на тумора, без да компрометира мишката.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Протокол
Този протокол се занимава с хирургическа процедура при лабораторни мишки. Всички експерименти с животни трябва да бъдат прегледани и одобрени от институционалния комитет по грижа и употреба на животните (IACUC) поотделно. Тъй като подходът се основава на оцеляването и възстановяването на животните, осигурете адекватна анестезия, управление на болката и асептична хирургична среда през цялото време. Използвайте загряваща подложка, за да предотвратите хипотермия по време на операция и до възстановяване след анестезия.
1. от съображения
2. доставка на вирус до мишата простата
3. след оперативни процедури
- Дръжте клетката с мишките, претърпели операция, върху нагревателна подложка за 1 час след процедурата, за да се предотврати хипотермия, докато те напълно се възстановят. Ако се приложи антидотът, животното трябва да е будно няколко минути след инжектирането.
- Наблюдавайте ежедневно животните за подходящо заздравяване на рани и индикации за болка. Ако е необходимо, прилагайте допълнителни болкоуспокояващи в съответствие с институционалните насоки за грижа за животните.
- Отстранете кожните скоби след 4-5 дни, след като раната се затвори.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Представителни резултати
За да се оцени разпространението на вируса в мишата простата, пробите бяха анализирани три месеца след операцията. 12 мишки Rosa26-LSL-Cas9-EGFP експресират GFP в клетки, които са били изложени на протеина Cre, експресиран от вируса. Пробите от простатата бяха изследвани с флуоресцентен микроскоп, за да се идентифицират области с GFP сигнал (Фигура 2А). GFP сигналът показва активността на Cre в простатния епител, но не и ако редактирането на гена е индуцирано от ръководството CRISPR. Имунохистохимичните срези демонстрират фокусни области на клетки с висока експресия на pAKT (Фигура 2В), което показва загуба на Pten 13. Имунофлуоресцентно Co оцветяване на pAKT и GFP идентифицира двойно положителни клетки (Фигура 2). Това потвърждава трансформацията на простатните клетки от Адено-асоциирания вирус. Като цяло, тези резултати показват, че in vivo редактирането на CRISPR/Cas9 ген може да се извърши в простатния епител, използвайки свързания с Adeno вирус и мишката Rosa26-LSL-Cas9-EGFP.
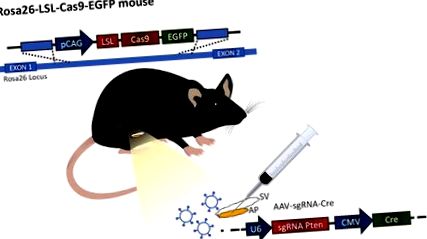
Фигура 1: Илюстрация на процедурата. Процедурата се извършва в мишката Rosa26-LSL-Cas9-EGFP, генерирана от Platt et al. 12 предната простата (AP) се присъединява към семенния мехур (SV). Вирусните частици експресират водеща РНК и протеин Cre се инжектират в предната простата, за да променят генната експресия. Щракнете тук, за да видите по-голяма версия на тази фигура.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Дискусия
В този протокол ние описваме метод за промяна на генната експресия в предния лоб на мишата простата чрез инжектиране на вируса, създавайки мощен нов миши модел за рак на простатата (Фигура 2). Успешното прилагане на аденовирус е описано за първи път от Leow et през 2005 г. 8. По-рано показахме как аденовирус, кодиращ протеин Cre рекомбиназа, може да замести отнемащите време кръстоски на Cre алел за елиминиране на специфични тъкани 9 (Фигура 2D). Тъй като вирусът заразява около 9 клетки, този модел имитира сценарий на човешко клонално разширение 14, 15 и е оптимален за проучвания на рака (Фигура 2В).
Откриването на технологията CRISPR/Cas9 отвори нови възможности за редактиране на живо на гена. Сега е възможно да се модифицират множество гени едновременно, осигурявайки много ценна техника за този хетерогенен рак по икономичен и ефективен начин. Изследванията с животински модели се възползват от предимството на генерирането на генни промени не само в зародишната линия, но и в тъканите на възрастни. Освен това, развитието на мишки, експресиращи Cas9, позволява вирусно доставяне на Cre и sgRNAs (Фигура 1). Тъй като указанията нямат въздействие върху генома без експресия на Cas9, работата с този вирус не е опасна.
Аденоасоциираните вируси индуцират много ниски имунни отговори и макар да присъстват до една година, вирусът не се интегрира в генома на гостоприемника, което го прави за предпочитане при in vivo проучвания за нокаут 16. В този контекст трябва да се отбележи, че различните серотипове могат да повлияят на ефективността на предаването на сигнала при различни видове тъкани. Следователно е от решаващо значение да се постигне висока ефективност на оптимизация за целевата тъкан. Използването на генетична интеграция на Lentivirus от друга страна позволява дългосрочна експресия на онкоген 10 .
Човешката простата не е разделена на различни лобове и се твърди, че мишите лобни простати най-добре представляват човешката простата. Въпреки че е предложен страничният лоб, не е показана значителна разлика между различните лобове по отношение на инициирането на тумор 9, 17, 18, 19. Друг критичен аспект на доставката на вируса е инфекцията на други клетки в тялото. Наблюдавали сме простатните стромални клетки, които са били трансдуцирани. Рискът може да бъде сведен до минимум по време на процедурата за ортотопична доставка, заобикаляйки кръвоносните съдове и предотвратявайки изтичане по време на инжектиране. Вирусният дизайн, включително специфичен за простатата промотор, като пробазин и серотип, може допълнително да увеличи клетъчната специфичност.
Необходим е абонамент. Моля, препоръчайте JoVE на вашия библиотекар.
Разкриване
Авторите нямат какво да разкриват.
Благодарности
Лорд е финансиран от безвъзмездна помощ от Датското раково общество (R146-A9394-16-S2). MFB и MKT са финансирани от AUFF NOVA (AUFF-E-2015-FLS-9-8). Lord и MFB са финансирани от Grad School, Health, AU. E.F.W. се подпомага със стипендии от Министерството на икономиката (SAF2015-70857, съфинансирани от ЕС ЕФРР) и безвъзмездна помощ от ERC (741888 - CSI-Fun).
Искаме да благодарим на Liliana Fajardo Mellor (Гени, развитие и болести; Национален център за изследване на рака) за критичното четене на ръкописа.
- Великобритания предупреждава за потенциално огнище на вируса на болестта син език при говедата
- Преживейте вируса в замразени храни WebSalud
- Имам човешкия папиломен вирус, как това се отразява на партньора ми
- TABATA 30 минути за отслабване - Доставка Fit
- ТАТИАНА ОРТУЗ КАРАНЕ СЪРЦА И РИВАЛИ НА ПОДЪЛЪКА И ПЪСТНЕТО - ВИРУСЪТ ЗА КОКС
