Синдром на ятрогенен Кушинг при кърмаче поради продължителна употреба на локални кортикостероиди. Доклад за случая
Javiera Hansen S. A
Patricia Lacourt R. B
Отделение по детска ендокринология, Катедра по педиатрия. Медицински факултет, Pontificia Universidad Católica de Chile. чили.
B Педиатрично ендокринологично отделение, болница за педиатрична служба д-р Sótero Del Río. чили.
Синдромът на Кушинг (CS) е ендокринологична патология поради излишък от глюкокортикоиди, зависим или независим от кортикотропинов хормон (ACTH). Основната причина е ятрогенна поради прекомерна употреба на глюкокортикоиди.
За да се демонстрира връзката между продължителната употреба на локални кортикостероиди и развитието на CS.
По-рано здрави по-възрастни бебета, лекувани с локални кортикостероиди поради себореен дерматит. Поради продължителната употреба без контрол, тя еволюира със синдрома на Кушинг, характеризиращ се със затлъстяване и компрометиран темп на растеж. Локалното приложение е спряно и терапията е започнала с намаляваща физиологична заместителна доза, като се постига клинично подобрение.
Локалните кортикостероиди се използват широко в клиничната практика за лечение на дерматологични патологии. Те се предлагат в различни презентации и силни страни. Основните определящи фактори в действието му са: характеристиките на кожата, активната съставка на лекарството, мощността и техниката на приложение, така че неблагоприятните ефекти се наблюдават по-често, когато се използват при обрив от пелена. Основният неблагоприятен ефект от продължителната употреба е развитието на синдрома на Кушинг, който може да бъде предотвратен чрез контролирана употреба и прогресивно намаляване.
Рационалната и внимателна употреба на локални кортикостероиди е от съществено значение, за да се възползвате от благоприятните ефекти и да избегнете появата на нежелани реакции.
Ключови думи: Синдром на Кушинг; локални глюкокортикоиди; Неблагоприятни ефекти; кортикостероиди
Синдромът на Кушинг е системно ендокринно разстройство, резултат от необичайно високи плазмени нива на кортизол. Честотата на CS е неточна, особено при педиатричната популация. Като цяло, най-честата причина е ятрогенен, вторичен след прекомерното екзогенно приложение на глюкокортикоиди. По отношение на ендогенния CS, това може да се случи по зависим или независим начин от увеличаването на секрецията на хормона кортикотропин (ACTH). В рамките на ендогенния CS, болестта на Cushing (кортикотропен аденом) се проявява в 60-70% от случаите при тези на възраст над 5 години, а при диференциална диагноза трябва да се има предвид извънматочната продукция на ACTH и, по изключение, извънматочната продукция на кортикотропин-освобождаващ хормон (CRH) . По отношение на независимите от ACTH случаи, хроничният хиперкортизолизъм инхибира секрецията на CRH и ACTH 2, чрез отрицателна обратна връзка. В тази група се препоръчва да се оцени наличието на едностранна (аденом/карцином) или двустранна (макро или микронодуларна надбъбречна хиперплазия) надбъбречна лезия, особено при деца под 5-годишна възраст .
Използването на локални глюкокортикоиди е важен инструмент в дерматологичната терапия, поради мощния си противовъзпалителен и антипролиферативен ефект. Въпреки това, продължителното излагане на мощни локални кортикостероиди може да доведе до вторични неблагоприятни ефекти като кожни прояви (кортикодермии), компрометирана скорост на растеж и потискане на оста хипоталамус-хипофиза-надбъбречна жлеза (HHA) 3, особено при липса на адекватно медицинско наблюдение.
Целта на тази презентация е да демонстрира връзката между продължителната употреба на локални кортикостероиди и развитието на нежелани ефекти (синдром на Кушинг и нарушена скорост на растеж).
Пациент от мъжки пол 1 година 2 месеца, насочен за оценка за нисък ръст с нарушена скорост на растеж от 6-месечна възраст. Първо дете на родители, които не са роднини, контролирана физиологична бременност. 40-седмично новородено, подходящо за гестационна възраст (RNT AEG) с тегло при раждане 3195 g и дължина 49 cm, без патология в неонаталния период. Не е описана съответна болестна история.
По време на първата оценка в поликлиниката по детска ендокринология се откроява характерен кушингоиден фенотип, поради което директно се иска използването на кортикостероиди. По време на третия месец от живота, пациентът беше оценен в неговия CESFAM поради картина на дерматит в скалпа и перинеалната област, без предшественик на подлежащия атопичен дерматит. Като се има предвид това, беше показано локално лечение с 1% хидрокортизон ацетатен крем, свързано с клотримазол. Впоследствие пациентът продължава с дерматологично състояние, така че показанието е променено на крем с бетаметазон дипропионат 0,05%. Поради добрия първоначален клиничен отговор на лечението, майката поддържа използването на крем при всяка линеене, достигайки 10 месеца непрекъснато лечение, без нова преоценка от здравния екип. Пациентът няма друга подходяща лична или семейна история.
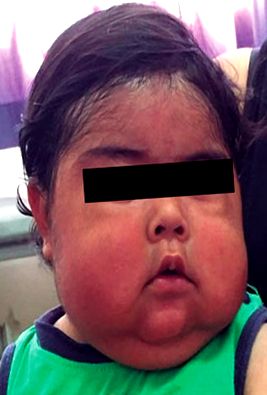
По време на физическия преглед пациентът представи кушингоидна фация с малки очи, шаранска уста, подпухнали бузи, битмпопорална мазнина, хипертрихоза и двойна брадичка (Фигура 1). В рамките на неговата антропометрична оценка се откроява намалена връзка височина/възраст със Z оценка -4,26 и повишена връзка тегло/височина със Z оценка +2,93 (Фигура 2). По същия начин е изследвано повишаване на кръвното налягане (BP 108/64 mmHg), като се има предвид 95-ия процентил (BP 102/54 mmHg) според пола, възрастта и ръста 12. Останалата част от изследването без значителни промени, с изключение на персистирането на лек перинеален еритем.
Фигура 1 Първа амбулаторна консултация на възраст от 1 година и 2 месеца.
Фигура 2 Крива на растеж с първоначално влошаване на скоростта на растеж.
Повишено бе подозрението за ятрогенен синдром на Кушинг, свързан със затлъстяване, вторична хипертония от етап 1 (НТ) и нисък ръст с лоша скорост на растеж. При първоначалното лечение беше показано незабавно спиране на локалния кортикостероид и лечението с хидрокортизон беше започнато перорално (перорално) във висок физиологичен диапазон на дозата (13,5 mg/m 2/ден), като се обучихме относно корекцията на дозата в лицето на остра патология. Що се отнася до управлението на HT, той се управлява временно с хидралазин (1,5 mg/kg/ден или фракциониран на всеки 8 часа) според съвместна оценка с педиатричната нефрология. Изисква се изходно биохимично проучване, показващо смесена дислипидемия (общ холестерол = 213 mg/dL и триглицериди = 153 mg/dL), нормална функция на щитовидната жлеза и забавена костна възраст (OS) (OS 6 месеца за хронологична възраст от 1 година 3 месеца).
Пациентът еволюира благоприятно с прогресивно намаляване на признаците на Кушинг (фигура 3), свързано с подобряване на скоростта на растеж и прогресивна загуба на тегло. След завършване на 6-месечно заместително лечение с перорален хидрокортизон (13 mg/m 2/ден), започва прогресивно намаляване до 10 mg/m 2/ден и се изисква сутрешно измерване на базален кортизол, за да се оцени възможната суспензия. Изследването показа изходен кортизол от 7,3 ug/dL, за който се поддържа физиологична доза (8 mg/m 2/ден vo) и се изисква микродоза ACTH тест (1 ug). Този тест беше извършен накрая след едногодишно лечение с хидрокортизон, като в резултат се получи кортизол преди ACTH от 6.32 ug/dL и след ACTH от 24.2 ug/dL (нормална референтна стойност> 18 ug/dL). лечението е прекратено.
Фигура 3 Проследяване след 3 месеца, 9 месеца и 1 година лечение с перорален кортизол.
Локалните кортикостероиди се използват широко в детската популация за лечение на различни дерматологични патологии. Те се предлагат в различни презентации, концентрации и потенции, 4 класифицирайки ги в групи от I до VII, съгласно последната характеристика 5-7 (Таблица 1) 10. Клобетазол-пропионатът е най-мощният препарат, свързан със системни странични ефекти, но всеки кортикостероид, прилаган в достатъчно количество, продължителност и удължаване, може да ги произведе 5 .
Таблица 1 Класификация на локалните кортикостероиди според потентността и носителя. 6
Описани са четири определящи фактора при прилагането на локални кортикостероиди, свързани с по-голям риск от развитие на странични ефекти: кожа (площ, разширение и обезщетение на бариерата), активен принцип на лекарството (потентност), носител (форма на представяне) и техника на приложение (доза, честота и продължителност на лечението) * 4, 9) .
При деца се препоръчва да се използват локални кортикостероиди с възможно най-ниска ефективност (Таблица 1), оценяващи абсорбцията според представянето на лекарството, като се има предвид по-голяма абсорбция в случай на по-голяма пукнатина (мехлем> крем> гел> лосион> аерозол> прах) . Що се отнася до кожата, децата са особено податливи на развиващи се системни нежелани реакции, поради по-висок дял на повърхността на кожата спрямо тяхното тегло (3, 5). Тънкостта на кожата е свързана с по-висока степен на абсорбция, особено области като лигавици, скротум и клепачи. От друга страна, хидратацията на кожата (предишно къпане), триенето и запушването благоприятстват проникването на лекарството. В този контекст основните рискови фактори за повишена абсорбция са прилагането върху възпалена кожа със загуба на бариерна функция и анатомичната област, лекувана за изтъняване в определени посочени области (лигавица и скротум) .
Патология, характеризираща се с наличието на двата фактора, е алергичен контактен дерматит на пелената. Това състояние трябва да се разграничава от дразнещ обрив на пелена (90% от случаите), тъй като управлението се променя значително. Докато алергичният дерматит може да се лекува с локални кортикостероиди и евентуално инхибитори на калциневрин след оценка от специалист по дерматология, дразнещият дерматит дава приоритет на възстановяването на кожната бариера чрез общи мерки като честа смяна на пелените и управление на евентуална интеркурентна гъбична инфекция.
Обикновено първоначалната индикация за локални кортикостероиди е оправдана от ползите при лечението на дерматологична патология 9 и освен това подходящото им използване води до редки леки неблагоприятни ефекти, като се вземе предвид изборът на кортикостероиди с най-ниска сила за правилно контролиране на заболяването начин 5. Поради гореизложеното здравният екип трябва да инструктира пациента за правилната употреба на тези лекарства и да ги обучи относно възможните неблагоприятни ефекти 5 .
Нежеланите реакции при продължителна употреба на локални кортикостероиди включват потискане на оста HHA и синдром на Кушинг с нарушена скорост на растеж. Потискането на оста H-H-A, вторично спрямо екзогенните кортикостероиди, е най-честата причина за надбъбречна недостатъчност 8 и може да се наблюдава при до 48% от пациентите, лекувани с мощни кортикостероиди. Рискът от потискане се увеличава в зависимост от приложената доза и продължителността на лечението. По същия начин периодът на възстановяване на функционалността на надбъбречната ос е пропорционален на времето и интензивността на потискането и може да отнеме седмици или месеци, за да се активира отново. Що се отнася до CS, характерният клиничен тип е чест, докато влошаването на кривата на растеж е по-малко описано. В случай на клинично подозрение за CS, наличието на хиперкортизолизъм трябва да бъде потвърдено биохимично/хормонално. След това, след потвърждение, се препоръчва да се завърши проучване, насочено към установяване на причината чрез измерване на плазмения ACTH и оценка на образа, според случая.
В контекста на представения случай и по-високата честота на ятрогенната причина, основен аспект на лечението е суспендирането на локалния кортикостероид и добавките с хидрокортизон във физиологични дози (9-12 mg/m 2/ден) в неговите ентерални или па рентерал. По същия начин намаляването на добавките трябва да се извършва постепенно и постепенно, за да се даде възможност за повторно активиране на оста и правилната функционалност на надбъбречната жлеза. По време на проследяването важен аспект, който трябва да се има предвид, е образованието и профилактиката на остра интеркурентна патология, поради висок риск от предизвикване на надбъбречна криза, ако дозата не се увеличи временно, за да се реагира на стрес.
И накрая, трябва да се отбележи, че се препоръчва да се оцени адекватната надбъбречна функция чрез измерване на изходния кортизол и/или ACTH тест, като последният се счита за златен стандарт 4, 5 .
Нашият пациент представи класически клинични признаци на излишък на кортикостероиди. По време на ранна детска възраст антропометричният модел, характеризиращ се с увеличаване на теглото, свързан със загуба на темп на растеж, трябва да доведе до подозрение за синдром на Кушинг в рамките на диференциалната диагноза. Рационалната и внимателна употреба на локални кортикостероиди носи множество терапевтични ползи и може да избегне появата на важни нежелани реакции.
Защита на хората и животните: Авторите декларират, че следваните процедури са били в съответствие с етичните стандарти на отговорния комитет за експериментиране с хора и в съответствие със Световната медицинска асоциация и Декларацията от Хелзинки.
Поверителност на данните: Авторите декларират, че са следвали протоколите на своя работен център за публикуване на данни за пациентите.
Право на поверителност и информирано съгласие: Авторите са получили информираното съгласие на пациентите и/или субектите, посочени в статията. Този документ се притежава от съответния автор.
Конфликт на интереси: Авторите не декларират конфликт на интереси.
1. Ashish T, Manjusha G, Pankaj P, Poorva G. Локално-стероидно-индуциран ятрогенен синдром на Кушинг в педиатричната възрастова група: Рядък доклад за случая. Индийски J Endocrinol Metab. 2013; 17 (Suppl1): S257-8. [Връзки]
2. Kling MA, Roy A, Doran AR, et al. Цереброспинална течност имунореактивен кортикотропин-освобождаващ хормон и секреция на адренокортикотропин при болест на Кушинг и голяма депресия: потенциални клинични последици. J Clin Endocrinol Metab 1991; 72: 260. [Връзки]
3. Pranab S, Nilendu S, Nilanjan S, Prashant S. Наводнен случай на синдрома на ятрогенния Кушинг, предизвикан от локален стероид с остеопороза и хипогонадизъм. Индийски J Dermatol. 2015 г .; 60 (4): 420. [Връзки]
4. Dhar S, Seth J, Parikh D. Системни странични ефекти на локални кортикостероиди. Индийски J Dermatol. 2014; 59 (5): 460-4. [Връзки]
5. Casado-Verrier B, Sanz-Canalejas L, Gómez-Fernández C, Pagán B, López M, Casado-Jiménez M. Синдром на ятрогенния Кушинг поради локални кортикостероиди при двама възрастни. Med Cutan IberLat Am 2012; 40 (2): 58-61. [Връзки]
6. Информация за предписване на модела на СЗО: Лекарства, използвани при кожни заболявания. 1999. [Връзки]
7. Decani S, Federighi V, Baruzzi E, Sardella A, Lodi G. Ятрогенен синдром на Кушинг и локална стероидна терапия: поредица от случаи и преглед на литературата. J Dermatol Treat. 2014; 25: 495-500. [Връзки]
8. Messazos B, Zacharin M. Уроци от ятрогенен синдром на Кушинг при деца. J Paediatr Child Health. 2016; 52: 1106-10. [Връзки]
9. Motes M, Suárez E, Velázquez P, Cedeño Y. Синдром на Cushing, вторичен при лечение със стероидни кремове. Holguín Medical Scientific Mail 2008: 12 (5). [Връзки]
10. Hengge UR, Ruzicka T, Schwartz RA, Cork MJ. Неблагоприятни ефекти на локални глюкокортикостероиди. J Am Acad Dermatol. 2006; 54 (1): 1-18. [Връзки]
11. Lacroix A, Feelders R, Stratakis C, Nieman L. Синдром на Cushing. Лансет. 2015; 386 (9996): 913-27. [Връзки]
12. Flynn JT, Kaelber DC, Baker-Smith CM, et al. Насоки за клинична практика за скрининг и управление на високо кръвно налягане при деца и юноши. Педиатрия. 2017; 140 (3): e20171904. [Връзки]
Получава: 06 септември 2017 г .; Одобрен: 24 януари 2018 г.
- Лечение (MRKH) и перспективи на синдрома на Mayer-Rokitansky-Küster-Hauser; Новини-Медицински
- Прогнозна стойност на метаболитния синдром по време на бременност за развитието на захарен диабет и
- Какво да ядем, за да облекчим ПМС
- Лечение на синдрома на Rett и неговите усложнения - Salud al día
- Синдром на Алпорт MedlinePlus медицинска енциклопедия