РАЗГЛЕЖДАНЕ НА АПАРТАМЕНТА
КИНЕТИЧЕН ЕКСПЕРИМЕНТ ЗА ЛАБОРАТОРИИ С ВИСОКО НИВО
Боливийски частен университет
Въведение.
Изкуственият подсладител α-L аспатил-L-фенилаланин-L-метилов естер е обект на голям брой експерименти, включително няколко анализа, синтез и проучване в отговор на сладостта. Това проучване описва кинетично изследване на аспартам във воден разтвор. Експериментът е приложим за физикохимични или биофизични химически лаборатории, може да се използва и като последващо проучване за гореспоменатите анализи. Предвид големия брой приложения на този компонент в диетични напитки, кисело мляко и сладолед, има голям интерес към процеса на разлагане.
Аспартамът се метаболизира изцяло от организма, при хидролизата му се получават аспарагинова киселина, метанол и фенилаланин.
Използва се като нискокалоричен подсладител и не причинява кариес. Използва се за подслаждане на различни храни и напитки, а също и като трапезна „захар“. Максималният дневен прием е 40 mg/kg.
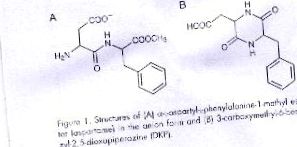
Той е най-важният от новите изкуствени подсладители. Открит през 1965 г., първоначално е разрешен за употреба в Съединените щати като настолен подсладител, въпреки че от 1983 г. е разрешен в тази страна като добавка в широк спектър от продукти. Химически това е генетично модифициран продукт, молекулата му се състои от три елемента (две аминокиселини и един алкохол): фенилаланин (50%), аспарагинова киселина (40%) и метанол (10%). Фенилаланинът се разпада на вещество, наречено дикетопиперазин (DKP), което причинява мозъчни тумори.
Описание на експеримента.
Аспартамът във воден разтвор се разпада на различни продукти в зависимост от рН. При неутрално или основно рН загубата на метанол преобладава, за да се образува 3-карбоксиметил-6-бензил-2,5-диоксопиперазин, обикновено съкратен до 2,5-дикетопиперазин или DKP и малко α-L-аспатил-L-фенилаланин. В изследвания експеримент рН се поддържа на 7,0, където основният продукт е DKP, а аспартамът съществува в приблизително 50:50 смеси от Zwiterion и анионни форми. Наличието на крайната аминогрупа в депротонирана форма е необходимо за нуклеофилната атака върху карбоксилния въглерод, както е показано на схема I. Освен зависимостта от рН, обхватът се влияе и от идентичността и концентрацията на буферната система. По-специално има по-голяма степен на подобрение, когато е налице фосфат, вероятно поради способността да дарява и приема едновременно протон, както е показано на схема I. В този експеримент буферният ефект се изследва чрез измерване на 0,20 М диапазона на фосфат и 0,20 М цитрат, и двата могат да бъдат намерени в диетичните напитки, но при много по-ниски концентрации в търговските продукти. Фосфатът също така съдържа натриев хлорид за повишаване на общата йонна сила до 1,0 М.
На постоянни интервали от време се изтеглят аликвотни части от 100 μL и се прехвърлят в епруветки, съдържащи 200 μL фосфатен буферен разтвор при 0,025 М и рН 3,0. Комбинираните ефекти на разреждане, охлаждане и намаляване на концентрацията и рН на буферния разтвор спират реакцията. При първа възможност разредените аликвотни части се разделят на колона с обратна фаза С18 (химически свързана обратна фаза, съставена от линейни въглеводородни вериги с 18 въглеродни атома)
и като подвижна фаза смес, съставена от 45% метанол и 55% фосфатен буфер (воден) 0,025 М с рН = 3. Първите аргументи се получават чрез нанасяне на ln (At-A∞) спрямо времето, където At-A∞ са пикови области на аспартам съответно в моменти t и безкрайност.
Метанолът в HPLC буферен разтвор може да причини зрителни проблеми и възможна слепота, ако е бил вдишван или погълнат. При контакт с кожата може да се получи леко дразнене или сухота.
Дикетопиперазин (DKP) причинява мозъчни тумори; Ето защо Администрацията по храните и лекарствата (FDA) нареди всички продукти, съдържащи аспартам, да носят легендата „Фенилкетонурик: Съдържа фенилаланин“. Аспарагиновата киселина е друг канцероген в тази смес.
Третият компонент е метанол или дървесен алкохол. Този алкохол заслепява или убива пиячите, които консумират подправени или тайно произведени алкохолни напитки.
Веднъж попаднал в тялото, метанолът, който вече се разлага на формалдехид, за да се опита да го елиминира, се съхранява в мастната тъкан, а останалата част се превръща в мравчена киселина, друг канцероген. Това означава, че с всяка глътка, която се дава на „лека“ или „диетична“ сода или друг продукт, съдържащ аспартам (дъвка, кисело мляко, зърнени храни, храна, сладкиши и дори „лекарства“!), Консумирате три канцерогена: мравчена киселина, формалдехид и фенилаланин DKP, сред много други продукти, които са резултат от разграждането на аспартама в тялото.
Аргументите от първия ред за системата от трите получени реакции са показани на Фигура 2. Таблица 1 съдържа диапазоните на константата (Kobs) и енергиите на активиране (Ea). Средната енергия на активиране е 71,9 + - 8,5 Kj/mol, което се сравнява благоприятно с резултата от 58 + - 9 Kj/mol, получен от Tsoubeli и Labufa с използване на 0,10 M фосфат и pH 7. Bell и Wetzel са получили константа на обхвата 0,00352 + 0,00005 1/min, използвайки 0,20 М фосфат pH 7,0 при 25 ° C. За този експеримент, използваната наблюдавана енергия на активиране и константата на диапазона при 40 ° C бяха използвани за изчисляване на стойността при 25 ° C. С данните в таблица 1 резултатът е 0,00461 + - 0,00061 1/min, което е разумно съгласуван резултат с този на Bell and Wetzel.
Заключения
5.1. Лабораторни заключения.
Разграждането на аспартама е популярен експеримент за студенти по физикохимична и биофизична химия, който дава добри резултати. С ефективно използване на времето проста група студенти могат да завършат експеримента в 5-часова лаборатория. Ако приемем, че курсът се управлява на въртяща се система. С една група ученици, които извършват експеримента всяка седмица, единственият основен инструмент, който се изисква, е течен хроматограф с UV детектор с променлива дължина на вълната, студентите могат да научат понятията за химическа кинетика и връзката с консумацията на съхраняваните продукти
Лични заключения.
След провеждане на изследването и изучаване на реакцията на аспартама при разлагане е важно да се подчертае, че той не е толкова вреден, колкото се смята, тъй като в търговските продукти той се намира в концентрации, много по-ниски от тези, разглеждани в лабораторията, но във всеки случай все още е смъртен враг за човека, който трябва да бъде контролиран.
Също така чрез това изследване научихме за хроматографите и тяхната работа при анализа на вещества, в случая аспартам.
И накрая, важно е да се знае средното време на живот на съединенията, за да се вземат правилните предпазни мерки при консумацията на определени химични съединения.
Библиография.
Списание за химическо образование - кн. 82 - № 6 юни 2005 г.
„Сладко обещание или горчива реалност“ - El Nuevo Diario - неделя, 13 ноември.
"Течна хроматография под високо налягане". H. M. McNair и B. Esquivel. Научна монография на OAS.
Важни данни.
Синоними: Аспартил-фенилаланин метилов естер
Химично наименование: α-L аспатил-L-фенилаланин-L-метилов естер
E номер: E 951
Химична формула: C14H18N2O5
Относителна молекулна маса: 294.31
Описание: Бял кристален прах без мирис със сладък вкус, приблизително 200 пъти по-сладък от захарозата.
Разтворимост: Леко разтворим във вода и етанол.
Загуба при сушене: Не повече от 4,5% (105 ° C, 4 часа).
Сулфатна пепел: Не повече от 0,2% в сухо тегло.
рН: между 4,5 и 6,0 (разтвор 1 на 125).
Арсен: Не повече от 3 mg/Kg в сухо тегло.
Олово: Не повече от 1 mg/Kg в сухо тегло.
Тежки метали: Не повече от 10 mg/Kg, изразени в Pb в сухо тегло.
5-бензил-3,6-диоксо-2-пиперазин-цетинова киселина: Не повече от 1,5% в сухо тегло.
- Намерете тук информация за карта на Insuficiencia; тук за вашето училище Влезте сега! Vago Corner
- Влезте тук, ако търсите БЕЗ ГЛУТЕН БРАШНО, подходящо за целиаки
- Информация за семейства CEIP SAN WALABONSO 2019
- Това са храните, които трябва да ядете за борба с отпуснатостта - Информация
- Хранителни факти за лененото семе и ползи за здравето