Този пълен текст е редактираната и преработена стенограма на конференцията, дадена в рамките на IV конгрес на Чилийската асоциация по клинично хранене, проведен в Сантяго от 28 до 30 април 2005 г. Събитието беше организирано от Чилийската асоциация по клинично хранене.
Президент на Чилийската асоциация по клинично хранене: д-р Жулиета Клаасен.
Научно издание: Дра. Елиана Рейес.
Въведение
Критичните пациенти обхващат широк спектър от сериозни медицински и хирургични патологии, които трябва да бъдат управлявани в отделение за интензивно лечение. Хранителната подкрепа на пациента в интензивното отделение има следните цели, след като пациентът достигне хемодинамична стабилност:
- Предотвратяване на недохранване: Пациентът ще бъде на нулев режим за поне 5 до 10 дни (период, препоръчан от настоящите стандарти на Американската асоциация за ентерално и парентерално хранене, за да започне подкрепа), тъй като недохранването е свързано с по-голяма заболеваемост.
- Насърчаване на протеиновия синтез, така че раните, мускулите и червата да могат да бъдат възстановени, а протеините, които участват в защита срещу инфекция, да се произвеждат.
Имайки предвид тези цели, има няколко определения, които трябва да запомните:
- Хиперметаболизъм е увеличението на енергийните разходи в покой; е причина за загуба на мускули при критично болни пациенти.
- Катаболизъм Това е загубата на тъкан, с отрицателен азотен баланс, поради увеличените загуби на азот. Това се случва от скелетните мускули и осигурява аминокиселини за глюконеогенеза и синтез на протеини с остра фаза.
- Анаболизъм означава синтез на тъкани и за това е необходимо да се постигне положителен азотен баланс.
Когато енергийното снабдяване е адекватно (1500 кал/ден), увеличаването на приема на азот може да подобри азотния баланс; Това се случва само когато приемът на калории е достатъчен, дори ако приемът на протеин е увеличен, както е показано от проучване, публикувано през 1981 г.
При критичния пациент настъпват сериозни метаболитни промени, които водят до по-голяма заболеваемост поради състоянието на недохранване, което причиняват. Известно е, че 1 g загуба на азот в урината се равнява на загуба на 30 g чиста тъкан; тоест пациент с 15 g азот от урея в урината губи половин килограм чиста маса. Доказано е, че 0,64 g чиста маса се губят следоперативно на ден (Shizal H. Хирургия 1979; 85: 496-503).
Трябва да се оцени връзката между риска и ползата от установяването на хранителна подкрепа при критично важния пациент. Рискът се увеличава при нестабилни пациенти, тъй като претоварването с обем, хипергликемия, електролитни и киселинно-алкални нарушения или диария могат лесно да бъдат предизвикани.
Основи на хранителната подкрепа
Хранителната подкрепа би била оправдана от следните елементи:
- Съществува връзка между хранителния статус и клиничната еволюция, както се вижда от проспективни и ретроспективни проучвания за ефикасността на хранителната подкрепа при тези пациенти.
- Хранителната подкрепа, понякога, също подобрява маркерите за недохранване.
- Трябва да се помни, макар да изглежда очевидно, че живите организми могат да умрат, ако са лишени от хранителни вещества за определено време.
- И накрая, понякога е по-добре да се направи нещо, отколкото да не се прави нищо, защото може да се постигне някаква полза и освен това намалява чувството за безпомощност пред пациентите (Koretz R. Am J Respir Crit Care Med деветнадесет и деветдесет и пет; 151: 570-3).
Тези основи обаче съдържат няколко грешки:
- Не е доказано, че асоциацията е причината; недохранването може да е последица от основното заболяване на пациента.
- Подобрените маркери не означават или гарантират, че ще има клинично подобрение.
- Смъртта, причинена изключително от недохранване, спрямо основното заболяване, настъпва, когато се загубят повече от 40% от теглото.
- Неконтролираните проучвания не гарантират какво се случва, когато интервенцията не се извършва.
- Интервенцията, която е вредна за пациента, е по-лоша от това да не се прави нищо.
При прегледа на настоящата литература с цел да се определи дали хранителната подкрепа влияе върху еволюцията на критичните пациенти, се появяват разочароващи данни за тези, които използват тази мярка, тъй като някои мета-анализи показват, че при парентерално хранене смъртността се увеличава; освен това няма дискусия, че инфекциите намаляват с ентерално хранене в сравнение с парентерално хранене. Що се отнася до ентералното хранене, стомашното хранене би имало повече усложнения от храненето на тънките черва.
Тъй като една от иконите на хранителната подкрепа, парентералното хранене, е свързана с повишена смъртност, различни аспекти на тази процедура започнаха да бъдат преразглеждани. На първо място, парентералното хранене се използва, когато има временна или трайна загуба на функцията на органа; В този смисъл тя трябва да се тълкува по същия начин като използването на диализа (т.е. когато бъбреците са недостатъчни) или инсталирането на механична вентилация (когато пациентът има дихателна недостатъчност).
Да се анализира резултатът от парентерално хранене срещу стандартни грижи при критични пациенти е извършен мета-анализ на 26 проучвания, от които само 6 са проведени при пациенти с интензивно отделение и две от тях се отнасят до ентерално хранене, следователно са останали 4 проучвания, някои доста стари и с редица на намален брой пациенти: Abel, 1976, 44 недохранени пациенти, сърдечна хирургия; Sax, 1987, 54 пациенти; Reilly, 1990, 18 недохранено, трансплантация на черен дроб; Sandstrom, 1993, 300 пациенти с травматична хирургия. В този мета-анализ парентералното хранене няма ефект върху смъртността спрямо стандартните грижи и вместо това е свързано с по-висока честота на усложнения и престой в болница.
При тези пациенти е важно да се знае основното заболяване, поради метаболитните промени, които може да причини; прилаганото лечение, тъй като калоричните нужди могат да варират; и хранителен статус, така че да не пречи на имунната система и пациентът да може да реагира адекватно на стрес.
Хранителният принос на критичния пациент трябва да бъде внимателно оценен, за да не се подхранва пациента; последният може да влоши загубата на чиста маса, да затрудни оттеглянето на вентилацията, да забави заздравяването, да промени защитните сили и следователно да увеличи инфекциите. Напротив, ако пациентът е претоварен над калоричните нужди, това може да предизвика усложнения като азотемия, чернодробна стеатоза, хиперкапния, хипергликемия, хиперлипидемия, претоварване с течности и електролитни нарушения.
Прием на калории и глюкоза
Когато решавате да започнете хранителна подкрепа при тези пациенти, е необходимо да определите колко калории да осигурите. Оптималното нещо би било да има непряка калориметрия, но това не е проста техника, тъй като изисква обучен персонал, отнема време и се обсъжда дали измерванията трябва да бъдат непрекъснати през 24 часа или е еквивалентно да се извършва в период от 10 или 15 минути.
На практика се използват формули за оценка на калоричните нужди; Като цяло се използва формулата на Харис Бенедикт, която дава стойността на енергийните разходи в покой (GER); Обикновено се счита, че 50% трябва да бъдат осигурени над енергийните разходи в покой и че 1,5 GER е еквивалентно на приблизително 36 kcal/kg/ден.
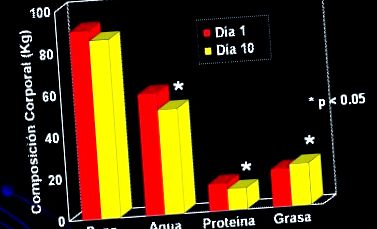
Фигура 1 показва какво се е случило с телесния състав при малка група пациенти, които са получавали хранителна подкрепа чрез парентерално хранене в продължение на 10 дни, след което е имало значителни промени в телесния състав, главно поради увеличената маса.
Що се отнася до приема на глюкоза, в проучване, проведено при 62 пациенти със средна възраст 62 години, с подобен енергиен прием, по-голям от 32 kcal/кило/ден, се наблюдава, че процентът на пациентите с нива на глюкоза в кръвта над 200 mg/dl се увеличава значително, когато е осигурено натоварване над 5 mg/kilo/минута (Фигура 2).
Фигура 1. Критични пациенти (n = 8), които са получавали 10 дни PN, 34 kcal/ден + 1,8 g/kg/ден протеин (Streat et al. J Травма 1987; 27: 262).
Фигура 2. Оптимален прием на глюкоза при парентерално хранене (Rosmarin et al. Nutr Clin Pract 1996; 11: 151).
Непряката калориметрия се счита за златен стандарт За определяне на енергийните нужди и в литературата се прилагат различни формули за оценка на тази стойност, сред които Харис Бенедикт; Fick's, който използва други променливи, като сърдечен обем и концентрация на хемоглобин; формулата на Ireton-Jones, която е специална за пациенти на механична вентилация и включва други променливи, като наличие на сепсис и др .; и уравненията на Франкенфийлд и Фуско.
Твърди се, че всички тези формули имат много добра корелация с индиректната калориметрия; Въпреки това, в проучване, проведено при голяма група критично болни пациенти, при което е извършена индиректна калориметрия на всички тях, е установено, че тези формули значително подценяват калоричните изисквания на пациентите и че техните коефициенти на корелация с калориметрията, като както се вижда в таблица I, те са били доста ниски.
Таблица I. Изчисляване на енергийните нужди при критичния пациент.
В друго проучване, проведено с индиректна калориметрия, формулирано да отговори дали приложеното хранене е в съответствие с калоричните изисквания, измерени чрез индиректна калориметрия, в сравнение със стойността, оценена от уравнението на Харис Бенедикт, е установено, че 48% от пациентите са хиперметаболитни (Фигура 3). Заболяването обаче е причинило намаляване на нуждите при 20% от пациентите; 31% остават нормално метаболитни (McClave et al. JPEN 1998; 22: 375-81).
На Фигура 4, с енергийния разход, измерен на килограм тегло, се наблюдава, че 66% от критично важните пациенти на интензивно отделение имат изисквания по-малко от 25 калории/килограм на ден и 33,3% от тях имат изисквания, по-големи от 25; Следователно това, което се използва по традиционен начин, т.е. над 35 калории/килограм/ден, не е в съответствие с изискванията.
Фигура 3. Хранене при критични пациенти. Той се прилага в съответствие с калориите?
Фигура 4. Хранене при критични пациенти. Разход на енергия за килограм тегло.
В класическо проучване за предоперативно хранене пациентите са разделени на две групи: едната група е получила 1280 калории, а другата е получила почти 3000 калории. Значително увеличение се наблюдава в процента на инфекциозни и неинфекциозни усложнения (Фигура 5), особено в честотата на нивата на кръвната захар над 300 mg/dl, в групата, която е получила най-голям принос (Buzby et al. N Engl J Med 1991; 325: 525).
Фигура 5. Усложнения на хипокалоричното парентерално хранене срещу конвенционален.
Има две други проучвания при критично болни пациенти за честотата на усложнения при нискокалорично хранене в сравнение с конвенционалното хранене. В единия от тях Чобан е работил с 13 пациенти със затлъстяване на интензивно отделение (1997), а в другия МакКоуън е направил същото с 48 пациенти на механична вентилация (2000). И двамата наблюдават значителна разлика в инфекциите между двата начина (29% срещу 53% във второто споменато проучване). До днес няма достатъчно данни за недохранване, така че тези сближения не са валидни при пациенти с хронично недохранване.
В проучването на пациенти със затлъстяване е сравнен парентералният хранителен прием от 22 kcal/kg/ден спрямо 36 kcal/kg/ден. Резултатите се виждат на Фигура 6; В зелените ленти се нанасят азотните баланси, които съответстват на крайната цел и която е сходна и в двете; с по-високия прием на калории има значително увеличение на нуждите от инсулин (Choban et al. Am J Clin Nutr 1997; 66: 546).
Фигура 6. Хипокалурично парентерално хранене срещу конвенционален. Разлики в нуждите от инсулин.
Може да се твърди, че по-голямото количество глюкоза ще доведе до по-голямо производство на CO2. В проучване, публикувано през 1992 г., пациентите са разделени на две групи: едната с по-висок прием на глюкоза и другата с по-висок калориен прием (Фигура 7). С по-високи количества глюкоза производството на CO2 не се увеличава, но когато се доставят 50% повече от изискванията, изчислени от Харис Бенедикт, тази променлива се увеличава значително (Talpers et al. Гръден кош 1992; 102: 551).
Фигура 7. Хипокалурично парентерално хранене срещу конвенционален. Индуцирано от храненето производство на CO2.
Що се отнася до приноса и парентералното хранене при критично важни пациенти, струва си да се припомни класическо проучване за употребата на инсулин при хирургични пациенти на интензивно отделение. Известно е, че при 75% от пациентите на интензивно отделение кръвната захар на гладно е по-голяма от 120 mg/dl; В това проучване група пациенти (n = 783) е разпределена на случаен принцип за конвенционално лечение, с добавен инсулин само ако гликемията е по-голяма от 215 mg/dl и с целева гликемия между 180 и 200 mg/dl; другата група (n = 765) получава интензивно лечение с инфузионна инфузия, ако гликемията надвишава нивото от 110 mg/dl, с таргетна гликемия от 80 до 110 mg/dl. Смъртността е била значително по-ниска, както при всички пациенти, така и в групата, която е получавала парентерално хранене или смесена подкрепа (Фигура 8).
С тези резултати може да се твърди, че при нива на глюкоза в кръвта смъртността между 80 и 110 mg/dl се намалява; В допълнение, това проучване намалява сепсиса, острата бъбречна недостатъчност, полиневропатията и трансфузиите; и важен факт е, че ползите от интензивната инсулинова терапия не зависят от начина на хранителна подкрепа. Трябва да се отбележи, че в голям процент пациентите са претърпели сърдечна операция; Така строга цел може да не е еквивалентна за други групи пациенти (Van den Berghe. N Engl J Med 2001; 345: 1359).
Фигура 8. Смъртност според гликемичния мениджмънт в хирургичната интензивна отделение.
Други уместни наблюдения са, че при тези пациенти резултатът на APACHE не е толкова висок и следователно състоянието им не е много сериозно. Освен това те получавали висок прием на глюкоза и в повечето случаи (60%) получавали общо парентерално хранене. В заключение на това проучване при хирургични пациенти, особено сърдечни пациенти, трябва да се извършва строг гликемичен контрол с цел от 80 до 110 mg/dl.
В друго проучване беше показано, че еволюцията на група критично болни пациенти на механична вентилация е по-добра с прием на енергия от 18 kcal/kg/ден, отколкото с по-малко от 10 или повече от 25 kcal/kg/ден. В последните два случая еволюцията беше по-лоша и беше по-трудно да се отучат пациентите (Гръден кош 2003,124: 297-305).
Заключения
- Понастоящем може да се твърди, че при добре подхранван критичен пациент неговите калорични нужди са от 22 до 25 kcal/kg, а при недохранван пациент - 30 kcal/kg/ден.
- Въпреки ограничената налична литература, няма заболяване, което да се подобрява значително при продължително гладуване (и само 15% от медицинските решения се основават на строги доказателства).
- Хранителната подкрепа при критично болни пациенти трябва да започне, ако пациентът няма да се подложи на хранене в рамките на 5 до 10 дни.
- Ентералното хранене е свързано с по-малко инфекциозни усложнения и оптималният прием предлага 25 kcal/kg и 1,5 до 2 g протеин/kg.
Насоките на ASPEN (Американско общество за парентерално и ентерално хранене), в която 200 специалисти са работили повече от три години, съдържат 322 препоръки. Само 62 от тях се основават на проспективни рандомизирани и контролирани проучвания (доказателства от тип А); 199 идват от по-малко строги данни, като ретроспективни проучвания; и 68 съответстват на мнението на експертите.
В обобщение, парентералното хранене работи най-добре, когато се извършва под формата на разрешително недохранване, което има следните характеристики:
- хипокалуричен е (повече от 15 и по-малко от 30 kcal/kg/ден);
- приносът на азота е висок (1,5 до 2 g/kg протеини);
- се извършва строг контрол на гликемията;
- имунохранването се счита за полезно в някои подгрупи.
- ОТГОВОРИ И СИНТЕЗ НА ХРАНИТЕЛНА ПОДКРЕПА НА ВЪЗРАСТНИЯ ПАЦИЕНТ
- Техника на мотивационно интервю за разговор с пациента с наднормено тегло и затлъстяване през
- Показания на пациент с наднормено тегло и резистентност към инсулин
- Хранителна терапия при пациенти със затлъстяване с инсулинова резистентност и сърдечно-съдов риск
- Ларинкса туберкулоза без белодробно участие при млад, имунокомпетентен пациент Insight Medical