Какво представляват селенопротеините?
Селенопротеините са изключителна група протеини, които включват в своята структура някои остатъци от селеноцистеин (Sec), считани за аминокиселина номер 21 на генетичния код. Тази необичайна аминокиселина е аналог на цистеин (Cys) и съдържа селен вместо сяра. Селенът е основен микроелемент в много организми и неговият дефицит е свързан с множество патофизиологични състояния като сърдечно-съдови заболявания, нервно-мускулни нарушения, рак или възпаление (Вячеслав М и др., 2014).
Остатъците Sec и Cys заемат хомоложни позиции, но Sec е по-реактивна аминокиселина от цистеина и е част от каталитичния домен на протеина. В селенопротеините с известна функция той винаги участва в окислително-възстановителните реакции. От еволюционна гледна точка и поради сходството на техните химични свойства се наблюдава специфично развитие на родословието от Sec до Cys и следователно е възможно да се намерят хомолози на селенопротеини, които включват Cys вместо Sec, определяйки ги като ортологични или паралогични гени (Zhang Y et al, 2006).
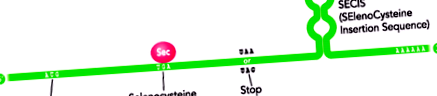
Включването на Sec в полипептидната верига се определя от неговото кодиране от кодона UGA, кодон, който обикновено определя прекратяването на транслацията на протеин. Това се случва, когато в 3'-UTR областта на иРНК на селенопротеините има запазена структура на стволови вериги, известна като SECIS елемент (SElenoCysteine Insertion Sequence) (Lobanov AV at al, 2009) (Фигура 1).
Фигура 1. Схематично представяне на структурата на иРНК на селенопротеин. Наблюдава се двойствеността на UGA кодона, кодираща, от една страна, аминокиселината Sec, а от друга, показваща завършването на транслацията. В областта 3 'UTR присъствието на елемента SECIS се откроява със запазена структура на веригата (модифицирана от Moghadaszadeh B et al, 2006).
Биосинтез на селенопротеини
Селенопротеините се характеризират с това, че съдържат аминокиселината Sec. Този остатък се кодира от UGA кодона (обикновено STOP кодон), присъстващ в отворената рамка за четене на гена, който се декодира като Sec по време на синтеза на рибозомния протеин от механизъм, специфично монтиран на каноничния транслационен апарат. Основният сигнал, който насочва прекодирането на UGA кодона, е вторична структура, присъстваща изключително в селенопротеиновите транскрипти, елементът SECIS. Тоест, SECIS елементът е този, който разграничава значението на UGA кодона и активира Sec машината за вмъкване.
Sec е единствената аминокиселина, чийто синтез се осъществява в собствената тРНК (няма свободен синтез на аминокиселини), наречена tRNA [Ser] Sec. Тази тРНК се аминоацилира със серин в реакция, катализирана от серил-тРНК синтетаза (SerS), за да се получи основната структура за биосинтеза на Sec. След това ще има фосфорилиране на серин от фосфосерил-тРНК киназа (PSTK). На свой ред селенът се форфорилира от селенофосфат синтетаза 2 (SPS2) и се добавя към вече фосфорилирания серин. На тази структура Sec-синтетазата (SecS) произвежда остатъка Sec, като по този начин образува Sec-tRNA [Ser] Sec (Bellinger FP et al, 2009) (Фигура 2).
Фигура 2. Механизъм на синтез на Sec. SerS аминоацилати tRNA [Ser] Sec със серин от SerS, пораждащ Ser-tRNA [Ser] Sec. Последният е фосфорилиран от PSTK, който осигурява субстрата на SecS заедно с фосфорилиран селен за синтеза на Sec-tRNA [Ser] Sec (модифициран от Labunskyy VM et al, 2014).
За включването на Sec-tRNA [Ser] Sec в рибозомата, тя трябва да бъде разпозната от специфичен коефициент на удължаване, наречен EFSec. EFSec не взаимодейства директно с елемента SECIS, а по-скоро чрез SECIS-свързващия протеин, известен като SBP2. В допълнение, други фактори като рибозомния протеин L30 (който е фактор за иницииране на транслация на еукариот, наричан още eIF4a3) участват в процеса на включване на Sec в отговор на наличието на UGA кодон в рамката за четене на гена (Bellinger FP et al, 2009) (Фигура 3).
Фигура 3. Механизъм на вмъкване на Sec в полипептидната верига. Елементът SECIS е междинен продукт от събирането на факторите EFSec, SBP2 и L30 към иРНК на селенопротеините, позволяващи включването на Sec в отговор на присъствието на кодон UGA (модифициран от Labunskyy VM et al, 2014).
Глобалното сходство на механизма на синтез и включване на Sec в трите области на живота предполага, че този феномен се е появил само веднъж в еволюцията, преди разделянето на тези домейни. Съществуването на родословни линии, които не включват Sec, показва, че в някои случаи този прародителски капацитет е загубен и това подкрепя идеята, че съществуват различни селективни натиски, които определят поддържането или загубата на включване на Sec.
Селенопротеинови семейства
Биологичните ефекти на селена се медиират най-вече от селенопротеините, които присъстват в археите, бактериите и еукариотите. С някои изключения, аминокиселината Sec е разположена в активния център на ензима, където тя медиира окислително-редукционните реакции на катализа (Arnér ES, 2010). Поради тази причина физиологичните роли, които селенопротеините приемат, зависят до голяма степен от наличието на Sec, така че специфични мутации, които засягат споменатата аминокиселина, могат лесно да предизвикат нейното инактивиране.
Класификацията на селенопротеините в семейства зависи от местоположението на Sec в аминокиселинната верига (Фигура 4). От една страна, първата група се състои от тези семейства, които имат Sec близо до С-терминалния край на протеина. Съставен е, например, от тиоредоксин редуктази (TrxRs) и селенопротеини S, I, O и K. От друга страна, позицията Sec в N-терминалния край образува втора група, в която глутатион пероксидазите (GPxs), йодотиронин деодинази (DIOs), селенопротеини H, M, N, T, V и W и селенофосфат синтетаза 2 (SPS2) (Lu J и Holmgren A, 2009).
Въпреки че молекулярните пътища, по които селенопротеините изпълняват различните си биологични роли, са много разнообразни и в много случаи неизвестни, повечето действат като изключително ефективни антиоксидантни ензими, образувайки част от тиоредоксиновата и глутатионната системи (Kryukov GV et al., 2003). Тези системи поддържат редокс хомеостазата на клетките за сметка на намаляващата сила на NADPH и участват, наред с други физиологични процеси, в метаболизма на тиреоидните хормони, узряването на сперматозоидите и мускулната функция (Labunskyy VM et al, 2014).
Фигура 4. Класификация и функции на различни семейства селенопротеини. Диаграма на относителната дължина на всеки тип селенопротеин е показана вдясно и местоположението на Sec е обозначено в червено (Labunskyy VM et al, 2014).
Еволюция на селенопротеини
Селенопротеомът е съвкупността от селенопротеини на организма и неговата еволюция се определя от условията на околната среда, в които организмите живеят, както и от наличието на селен (Lobanov AV at al, 2009). Например водните организми се характеризират с най-големите селенопротеоми. Напротив, в сухоземните организми количеството на селенопротеините е значително по-ниско. Една от най-мощните хипотези за обяснение на тази ситуация е, че антиоксидантната функция на селенопротеините играе ключова роля в защитата на клетките срещу високи концентрации на кислород (Jakupoglu C et al, 2005). Едно от последиците от прехода към сухоземни местообитания е ограничен достъп на няколко основни елемента като селен, който е значително по-малък. В резултат на това много сухоземни организми като висши растения, дрожди, гъби и някои видове животни губят семейства селенопротеини или ги заменят с хомолози, съдържащи цистеин (Lobanov AV et al, 2009).
Повечето от идентифицираните селенопротеини имат произход от предци и са генерирани главно по време на еволюцията от дублиране на гени. Анотирането на геноми, прилагането на биоинформативни методи за предсказване на нови селенопротеини и филогенетичните модели на реконструкция позволиха характеризирането на 45 семейства селенопротеини в гръбначните животни, от които 20 са генерирани от дублиране на съществуващ селенопротеин и 6 са част от родов селенопротеом (Mariotti M et al., 2012) (Фигура 5). Същото проучване заключава, че селенопротеомът на бозайниците е останал относително стабилен и се състои от общо 28 семейства, с до 25 гена, кодиращи селенопротеини за всеки вид бозайник. По същия начин, 21 често срещани селенопротеини са идентифицирани във всички гръбначни животни, докато останалите се намират само в определени линии. Това показва възможния произход на селенопротеините, включително дублиране на гени и заместване с цистеин.
Фигура 5. Еволюция на гръбначния селенопротеом. Родовите селенопротеини са обозначени в червено и техните еволюционни промени се отразяват от филогенетичното дърво. Тези подчертани селенопротеини са уникални за гръбначните животни, докато зеленият цвят показва образуването на нов селенопротеин чрез дублиране на гени. Изгубените селенопротеини през родовете са показани в сиво, а случаите, в които е настъпило заместване с цистеинов хомолог, са посочени в синьо (Mariotti M et al, 2012).
Анотация и прогнозиране
В заключение, анализът на секвенирани геноми, които позволяват да се анализира присъствието и разпределението на селенопротеините, заедно с подробното проучване на тяхната филогения, ще доведе до по-добро разбиране на функцията и значението на селенопротеините в човешката физиология и патология.
Macaca nemestrina
Южният макак със свински опашки (Macaca nemestrina) е вид примат от катарин от семейство Cercopithecidae. Обитава Малайския полуостров, Борнео, Суматра и остров Банка. Това е средно голям, всеяден макак, който живее предимно в горите, но с напредването на хората се среща и в плантации и градини. Преди подвидовете на този таксон сега са видове: Macaca leonina (северен макак със свински опашки), Macaca pagensis (макакът Пагай) и Макака сиберу (макакът от Сиберут). За повече информация щракнете тук.