2.1: Ранни идеи в атомната теория
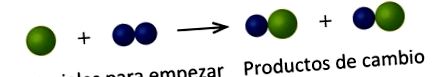
На следващия чертеж зелените сфери представляват атоми на определен елемент. Сините сфери представляват атоми на друг елемент. Ако сферите на различни елементи се допират, те са част от една единица от съединение. Следващата химическа промяна, представена от тези сфери, може да наруши една от идеите на атомната теория на Далтън. Който?
Изходните материали се състоят от зелена сфера и две сини сфери. Продуктите се състоят от две зелени сфери и две сини сфери. Това нарушава постулата на Далтън, че атомите не се създават по време на химическа промяна, а просто се преразпределят.
Кой постулат от теорията на Далтън е в съответствие със следното наблюдение относно теглото на реагентите и продуктите? При нагряване на 100 грама твърд калциев карбонат се получават 44 грама въглероден диоксид и 56 грама калциев оксид.
Идентифицирайте постулата на теорията на Далтън, който е нарушен от следните наблюдения: 59,95% от проба от титанов диоксид е титан; 60,10% от различна проба титанов диоксид е титан.
Това твърдение нарушава четвъртия постулат на Далтън: в дадено съединение броят на атомите от всеки тип (а следователно и процентът) винаги имат едно и също съотношение.
Анализират се проби от съединение X, Y и Z, като резултатите са показани тук.
| х | Бистра течност, безцветна, със силна миризма. | 1,776 g | 0,148 g |
| Y. | Бистра течност, безцветна, със силна миризма. | 1,974 g | 0,329 g |
| Z. | Бистра течност, безцветна, със силна миризма. | 7,812 g | 0.651 g |
Дават ли тези данни пример (и) на закона на определени пропорции, закона на множествените пропорции, нито на нито на двете, нито на двете? Какво ви казват тези факти за съединения X, Y и Z?
2.2: Еволюция на атомната теория
Обучение
- Съществуването на изотопи нарушава една от първоначалните идеи на атомната теория на Далтън. Който?
- Как си приличат електроните и протоните? Каква е разликата между тях?
- Как си приличат протоните и неутроните? Каква е разликата между тях?
- Предсказване и тестване на поведението на α частици, изстреляни срещу моделен атом на „сливов пудинг“.
- Предскажете пътищата, поети от α-частиците, които се изстрелват към атомите със структурата на модела пудинг от слива Thomson. Обяснете защо очаквате α частиците да поемат по тези пътища.
- Ако α частици с по-висока енергия от тези в (а) се изстрелват по атомите на сливовия пудинг, предскажете как пътищата им ще се различават от пътищата на α частици с по-ниска енергия. Обяснете своите разсъждения.
- Сега тествайте вашите прогнози за (а) и (б). Отвори Симулация на разсейване на Ръдърфорд и изберете раздела "Plum Pudding Atom". Задайте „Energy Particle Energy“ на „min“ и изберете „show traces“. Кликнете върху пистолета, за да започнете да снимате α частици. Това съвпада ли с вашата прогноза от (а)? Ако не, обяснете защо действителният маршрут би бил този, показан в симулацията. Натиснете бутона за пауза или "Нулиране на всички". Задайте "Енергия на алфа частици" на "max" и започнете да снимате α частици. Това съвпада ли с вашата прогноза от (б)? Ако не, обяснете ефекта от увеличаването на енергията върху реалните маршрути, както е показано в симулацията.
- Предскажете и тествайте поведението на изстреляни α частици в модел на атом на Ръдърфорд.
- (а) Предскажете пътищата, поети от α частиците, които са изстреляни към атоми със структура на модел на атом на Ръдърфорд. Обяснете защо очаквате α частиците да поемат по тези пътища.
- (б) Ако α частици с по-висока енергия от тези в (а) са изстреляни по атомите на Ръдърфорд, предскажете как техните траектории ще се различават от траекториите на α частици с по-ниска енергия. Обяснете своите разсъждения.
- (c) Предскажете как ще се различават пътищата, по които ще преминават α частиците, ако се изстрелват атоми на Ръдърфорд на елементи, различни от злато. Какъв фактор се надявате да причини тази разлика в пътищата и защо?
- (г) Сега тествайте вашите прогнози за (а), (б) и (в). Отвори Симулация на разсейване на Ръдърфорд и изберете раздела "Rutherford Atom". Поради мащаба на симулацията, най-добре е да започнете с малко ядро, така че изберете "20" за протоните и неутроните, "min" за енергията, покажете следите и след това започнете да снимате α частици. Това съвпада ли с вашата прогноза от (а)? Ако не, обяснете защо действителният маршрут би бил този, показан в симулацията. Поставете на пауза или рестартирайте, настройте енергията на "max" и започнете да изстрелвате α частици. Това съвпада ли с вашата прогноза от (б)? Ако не, обяснете ефекта от увеличаването на енергията върху реалния път, както е показано в симулацията. Поставете на пауза или рестартирайте, изберете "40" за протони и неутрони, "min" за енергия, покажете следи и стреляйте. Това съвпада ли с вашата прогноза от (c)? Ако не, обяснете защо действителният маршрут би бил този, показан в симулацията. Повторете това с по-голям брой протони и неутрони. Какво обобщение можете да направите относно вида на атома и ефекта върху пътя на α-частиците? Бъдете ясни и конкретни в отговора си.
Решения
1 Далтън първоначално смята, че всички атоми на даден елемент имат идентични свойства, включително маса. Следователно концепцията за изотопите, в която даден елемент има различни маси, представлява нарушение на първоначалната идея. За да се обясни съществуването на изотопи, вторият постулат от неговата атомна теория е модифициран, за да заяви, че атомите на един и същи елемент трябва да имат идентични химични свойства.
2 И двете са субатомни частици, които се намират в ядрото на атом. И двамата имат приблизително еднаква маса. Протоните са заредени положително, докато неутроните са незаредени.
3 И двете са субатомни частици, които се намират в ядрото на атом. И двамата имат приблизително еднаква маса. Протоните са заредени положително, докато неутроните са незаредени.
4. (а) Моделът на пудинг от слива показва, че положителният заряд е равномерно разпределен в целия атом, така че очакваме α частиците (може би) да бъдат намалени малко от положително положителното отблъскване, но да следват пътища в права линия (т.е. да не се отклоняват), докато преминават през атомите. (б) А-частиците с по-висока енергия ще пътуват по-бързо (и може би ще се забавят) и също така ще следват прави линии през атомите. (в) α частиците са следвали прави линии през атома на пудинговия слива. Не е имало видимо намаляване на α-частиците при преминаването им през атомите.
5. (а) Атомът на Ръдърфорд има малко, положително заредено ядро, така че повечето α частици ще преминат през празното пространство далеч от ядрото и няма да се отклонят. А-частиците, които преминават близо до ядрото, ще се отклонят от своите пътища поради положително-положително отблъскване. Колкото по-директно към ядрото са насочени α частиците, толкова по-голям е ъгълът на отклонение. (б) По-високите енергийни α частици, които преминават близо до ядрото, ще продължат да се отклоняват, но колкото по-бързо се движат, ъгълът на отклонение ще бъде по-малък от очакваното. (в) Ако ядрото е по-малко, положителният заряд е по-малък и очакваните отклонения са по-малки, както по отношение на това колко близо α-частиците преминават през ядрото без отклонение, така и ъгъла на отклонение. Ако ядрото е по-голямо, положителният заряд е по-голям и очакваните отклонения са по-големи: повече α частици ще се отклонят и ъглите на отклонение ще бъдат по-големи. (г) Маршрутите, следвани от α-частиците, съвпадат с прогнозите на (а), (б) и (в).
2.3: Атомна структура и символика
По какъв начин изотопите на даден елемент винаги са различни? По какъв начин те винаги са еднакви?
Напишете символа за всеки от следните йони:
- а) йонът със заряд 1+, атомното число 55 и масовото число 133
- (б) йонът с 54 електрона, 53 протона и 74 неутрона
- в) йонът с атомно число 15, масово число 31 и заряд 3
- (г) йонът с 24 електрона, 30 неутрона и заряд от 3+
(а) 133 Cs +; (б) 127 I -; (в) 31 Р 3-; (г) 57 Co 3+
Напишете символа за всеки от следните йони:
- а) йонът със заряд 3+, 28 електрона и масово число 71
- (б) йонът с 36 електрона, 35 протона и 45 неутрона
- в) йонът с 86 електрона, 142 неутрона и заряд от 4+
- (г) йонът със заряд 2+, атомно число 38 и масово число 87
Отворете симулацията, изградете атом и кликнете върху иконата на атом.
- (а) Изберете някой от първите 10 елемента, които искате да изградите, и посочете неговия символ.
- (б) Плъзнете протони, неутрони и електрони върху шаблона на атома, за да образувате атом от неговия елемент. Посочете броя на протоните, неутроните и електроните във вашия атом, също така посочете нетния заряд и масовото число.
- (в) Щракнете върху „Нетно натоварване“ и „Масово число“, проверете отговорите си в (б) и коригирайте, ако е необходимо.
- (г) Предскажете дали вашият атом ще бъде стабилен или нестабилен. Моля, посочете мотивите си.
- (д) Поставете отметка в квадратчето „Стабилен/Нестабилен“. Точен ли беше отговорът ви на (г)? Ако не, първо предскажете какво можете да направите, за да направите стабилен атом на вашия елемент, а след това продължете и вижте дали работи. Обяснете своите разсъждения.
(а) Въглерод-12, 12 С; (б) Този атом съдържа шест протона и шест неутрона. В неутрален атом от 12 С. има шест електрона. Нетният заряд на този неутрален атом е нула, а масовото число е 12. (в) Горните отговори са верни. (г) Атомът ще бъде стабилен, тъй като С-12 е стабилен изотоп на въглерода. (д) Предишният отговор е верен. Други отговори за това упражнение са възможни, ако е избран различен елемент от изотопа.
(а) Плъзнете протони, неутрони и електрони върху шаблона на атома, за да създадете неутрален кислород-16 атом и дайте изотопния символ за този атом.
(б) Сега добавете още два електрона, за да образувате йон и дайте символа за йона, който сте направили.
(а) Плъзнете протони, неутрони и електрони върху шаблона на атома, за да направите неутрален атом Литий-6 и дайте символа на изотопа за този атом.
(b) Сега премахнете електрон, за да образувате йон и дайте символа за йона, който сте направили.
(а) Литий-6 съдържа три протона, три неутрона и три електрона. Символът на изотопа е 6 Li или \ (\ ce<^6_3Li>\). (b) 6 Li + o \ (\ ce<^6_3Li+>\)
Определете броя на протоните, неутроните и електроните в следните изотопи, използвани при медицински диагнози:
(а) атомно число 9, масово число 18, заряд 1−
(б) атомно число 43, масово число 99, заряд 7+
(в) атомно число 53, атомно масово число 131, заряд 1−
(г) атомно число 81, атомно масово число 201, заряд 1+
(д) Назовете елементите в части (а), (б), (в) и (г).
По-долу са описани свойствата на изотопите на два елемента, които са от съществено значение за нашата диета.Определете броя на протоните, неутроните и електроните във всеки и ги назовете.
а) атомно число 26, масово число 58, заряд 2+
(б) атомно число 53, масово число 127, заряд 1−
а) желязо, 26 протона, 24 електрона и 32 неутрона; (б) йод, 53 протона, 54 електрона и 74 неутрона
Посочете броя на протоните, електроните и неутроните в неутралните атоми на всеки от следните изотопи:
Посочете броя на протоните, електроните и неутроните в неутралните атоми на всеки от следните изотопи:
(а) 3 протона, 3 електрона, 4 неутрона; (б) 52 протона, 52 електрона, 73 неутрона; (в) 47 протона, 47 електрона, 62 неутрона; (г) 7 протона, 7 електрона, 8 неутрона; (д) 15 протона, 15 електрона, 16 неутрона
Щракнете върху сайт и изберете раздела „смесване на изотопи“, скрийте полетата „процентно съотношение“ и „средна атомна маса“ и след това изберете елемента бор.
(а) Запишете символите за изотопите на бор, показани като естествени в значителни количества.
(б) Предскажете относителните количества (проценти) на тези борни изотопи, открити в природата. Обяснете мотивите, които стоят зад вашия избор.
(c) Добавете изотопи към черната кутия, за да направите смес, която съответства на вашата прогноза в (b). Можете да плъзнете изотопи от техните тави или да щракнете върху „Още“ и след това да преместите плъзгачите до съответните количества.
(г) Разкрийте полетата "Процент състав" и "Средна атомна маса". Колко добре вашият микс съвпада с вашата прогноза? Ако е необходимо, коригирайте стойностите на изотопа, така че да съответстват на вашата прогноза.
(д) Изберете изотопната смес от "Природа" и я сравнете с вашата прогноза. Колко добре се сравнява вашата прогноза с естествения микс? Обяснете. Ако е необходимо, коригирайте вашите суми, за да съответстват максимално на сумите "Природа".
Повторете упражнение използвайки елемент, който има три естествени изотопа.
Нека използваме neon като пример. Neon има три изотопа и няма начин да бъдем сигурни, че точно ще предскажем изобилието, за да направим общо 20,18 аму от средната атомна маса. Да предположим, че изобилието е 9% Ne-22, 91% Ne-20 и само следа от Ne-21. Средната маса ще бъде 20,18 amu. Проверката на естествената смес от изотопи показва, че изобилието е 90,48% Ne-20, 9,25% Ne-22 и 0,27% Ne-21, така че нашите оценки трябва да бъдат коригирани малко.
Елементът има следните естествени изобилия и изотопни маси: 90,92% изобилие с 19,99 amu, 0,26% изобилие с 20,99 amu и 8,82% изобилие с 21,99 amu. Изчислете средната атомна маса на този елемент.
Средните атомни маси, изброени от IUPAC, се основават на проучване на експериментални резултати. Бромът има два изотопа 79 Br и 81 Br, чиито маси (78.9183 и 80.9163 amu) и изобилие (50.69% и 49.31%) са определени в предишни експерименти. Въз основа на тези експерименти се изчислява средната атомна маса на бром.
Могат да се наблюдават вариации в средната атомна маса за елементи, получени от различни източници. Литий е пример за това. Изотопният състав на лития от природни минерали е 7,5% 6 Li и 92,5% 7 Li, които имат маси съответно 6,01512 amu и 7,01600 amu. Търговският източник на литий, рециклиран от военен източник, е 3,75% 6 Li (а останалата част 7 Li). Изчислете средните стойности на атомната маса за всеки от тези два източника.
Средните атомни маси на някои елементи могат да варират в зависимост от източниците на техните минерали. Естественият бор се състои от два изотопа с точно известни маси (10 B, 10.0129 amu и 11 B, 11.0931 amu). Действителната атомна маса на бор може да варира от 10 807 до 10 819, в зависимост от това дали минералният източник е от Турция или САЩ. Изчислете процентното изобилие, което води до двете стойности на средните атомни маси на бор за тези две страни.
Турция източник: 0,2649 (от 10,0129 аму изотоп); Американски източник: 0,2537 (от 10,0129 аму изотоп)
Съотношението на изобилие 18 O: 16 O в някои метеорити е по-високо от това, използвано за изчисляване на средната атомна маса на кислорода на земята. Средната маса на кислороден атом в тези метеорити е по-голяма, по-малка или равна на тази на земния кислороден атом?
2.4: Химически формули
Обяснете защо символът за атом на елемента кислород и формулата за кислородна молекула са различни.
Символът за елемента кислород, О, представлява както елемента, така и кислородния атом. Молекулата на кислорода, O2, съдържа два кислородни атома; Индексът 2 във формулата трябва да се използва за разграничаване на двуатомната молекула от два отделни кислородни атома.
Обяснете защо символът за елемента сяра и формулата за молекула сяра са различни.
Напишете молекулярните и емпирични формули за следните съединения:
- Какви упражнения да правя, ако имам наднормено тегло
- Какви упражнения да направя за намаляване на корема през 2018 г. 🏆
- Какви упражнения мога да направя, за да отслабя краката си у дома
- Какви плодови салати да ядем преди или след тренировка Хранене Упражнения Фитнес Диета
- Какви упражнения, полюс и друга физическа активност правите, колко често? Какви видове