Вижте статиите и съдържанието, публикувани в този носител, както и електронните резюмета на научни списания към момента на публикуване
Бъдете информирани по всяко време благодарение на сигнали и новини
Достъп до ексклузивни промоции за абонаменти, стартиране и акредитирани курсове
Испанската хирургия е официалният орган на Испанската асоциация на хирурзите (AEC) и на Испанското дружество по гръдна хирургия (SECT), и двете научни дружества обхващат по-голямата част от общите и гръдните хирурзи, както и други подспециалисти на испанската хирургия. Списанието е най-добрият показател за техническото и концептуално развитие на испанската хирургия, по такъв начин, че на неговите страници, подобно на еволюцията, която е претърпяла хирургията в света, все по-голямо внимание се отделя на биологичните и клиничните аспекти на хирургичната патология, надхвърляйки по този начин оперативния акт, който в миналото е бил основният фокус на вниманието в тази област на медицината. Съдържанието на списанието е структурирано в разделите „Оригинали“, „Рецензии“, „Клинични бележки“ и „Писма до редактора“, а статиите са подбрани и публикувани след строг анализ, следвайки международно приети стандарти.
Индексирано в:
SCIE/JCR, Index Medicus/Medline, IBECS, IME
Следвай ни в:
Импакт факторът измерва средния брой цитати, получени за една година за произведения, публикувани в публикацията през предходните две години.
CiteScore измерва средния брой цитати, получени за публикувана статия. Прочетете още
SJR е престижна метрика, базирана на идеята, че всички цитати не са равни. SJR използва алгоритъм, подобен на ранга на страницата на Google; е количествена и качествена мярка за въздействието на дадена публикация.
SNIP дава възможност за сравнение на въздействието на списанията от различни предметни области, коригирайки разликите в вероятността да бъдат цитирани, които съществуват между списанията на различни теми.
- Обобщение
- Ключови думи
- Резюме
- Ключови думи
- Въведение
- Обобщение
- Ключови думи
- Резюме
- Ключови думи
- Въведение
- Методология
- Хистопатология
- епидемиология
- Клиника и диагностика
- Лечение
- Заключения
- Конфликт на интереси
- Библиография
Аденокарциномът (ADC) на аналния канал е рядък обект, който представлява 5% от всички аноректални новообразувания и 1,5% от стомашно-чревни тумори. Според Световната здравна организация могат да се разграничат 3 вида: първият произхожда от преходната лигавица на горния канал, вторият произлиза от аналните жлези (канали), а последният произлиза от хронична перианална фистула. Пациентите с ADC на аналния канал имат по-висок процент на напреднало заболяване, отдалечени метастази и по-ниска обща преживяемост от тези с плоскоклетъчен карцином. Оскъдната публикувана казуистика за тази неоплазма предполага, че няма напълно доказана терапевтична схема. Повечето автори се застъпват за лечение на неоадювантна химиорадиотерапия (CRT), последвано от радикална хирургия. Целта на тази статия е да направи преглед на съществуващата литература за клиникопатологичните характеристики и управлението на ADC на аналния канал.
Аденокарцином (ADC) на аналния канал е рядко заболяване, обхващащо само 5% от всички аноректални неоплазии и 1,5% от всички стомашно-чревни тумори. Световната здравна организация класифицира аналния ADC на 3 вида: първият може да възникне от лигавицата на преходната зона в горния канал, вторият от аналните жлези (канали), а последният може да се развие в средата на хронична аноректална фистула. Пациентите с ADC на аналния канал имат високи нива на тазова недостатъчност, отдалечени метастази и по-ниска обща преживяемост от пациентите с епидермоиден карцином. Поради ограничените случаи на случаи за тази неоплазия, стратегиите за управление не са добре установени. Повечето автори на свързани изследвания препоръчват предоперативна химиорадиотерапия (CRT), последвана от радикална хирургия. Целта на настоящото проучване е да направи преглед на клиникопатологичните характеристики и управлението на ADC на аналния канал.
Аналният канал е крайната част на дебелото черво и съответства на 3-4 см тръбна структура, която се простира от перианалната кожа до края на ректума. В горната си част е облицована от лигавица от ректален тип, в средната зона (съвпадаща с линията на пектинеалния интерфейс) от преходна лигавица и в долната си част от лигавица със стратифициран плосък епител 1 .
Карциномите в този регион се класифицират като карциноми на аналния канал и моделите на диференциация са предимно базалиоиден тип (в основата си сквамозен по природа, подобен на неговия омоним в горната част на храносмилателния тракт), епидермоиден тип, аналогичен на кожни тумори и такива с линия на диференциация към аденокарцином 1 .
Целта на тази статия е да направи преглед на литературата по хистопатология, симптоми, диагностика и лечение на ADC на аналния канал.
Извършен е преглед на съществуващата литература, използвайки базата данни MEDLINE Pubmed и Ovid от 1997 до 2012 г. Използвани са ключови думи: „анален аденокарцином“, „анална новообразувание“, „карцином на аналната жлеза“, «карцином на аналния канал», «анален канал »,« имунохистохимия »,« химиорадиотерапия »и« радикална хирургия ».
Въпреки че аналният канал е кратък, той представлява голямо разнообразие от тумори, което отразява анатомичната, ембриологичната и хистологичната сложност на тази структура. Осигуряването на местоположението на тези тумори и интерпретирането на морфологичните находки е противоречиво и понякога много трудно 2 .
Аденокарциномът (ADC) на аналния канал е рядко явление. Повечето имат колоректален фенотип и представляват тумори, получени от горната част на аналния канал или от клетки с жлезисти характеристики на преходната зона. Разграничаването на истински ADC на анален канал от ниско ректално ADC с удължаване на анален канал може да бъде изключително трудно. Според Световната здравна организация (СЗО), 3 вида ADC могат да бъдат разграничени главно спрямо техния произход: тези, които произхождат от горната част на аналния канал, тези, които произхождат от аналните жлези или канали и тези, свързани с тях с хронични аноректални фистули 2,3:
-
-
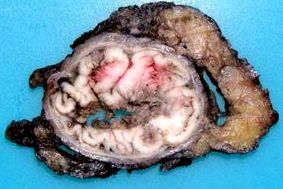
Туморите с произход от лигавицата на горната част на аналния канал са най-често срещани (фиг. 1) и представят колоректален фенотип. Изключително трудно е, в напреднали стадии, да се разграничат от дисталния ректален ADC. Основното му клинично значение се основава на локалния му капацитет за удължаване, отчитащ двойния лимфен дренаж към ингвиналната и бедрената вериги. Обичайният имунохистохимичен фенотип съвпада с имунохистохимичния профил на ADC с нисък ректален сегмент, състоящ се от CK20 +, CK7- и CDX2 +. CK7 от време на време е положителен, тъй като по изключение може да се появи и при ректален ADC, но както при този, той би изразил съвместно CK20 2,4,5 .
Повърхност на напречното сечение на аденокарцином (ADC) с произход от лигавицата на горния сегмент на аналния канал с периферен и ендолуминален растеж.
Последователни напречни сечения на еволюирал интрамурален ADC на аналните жлези А) на средната 1/3 от аналния канал и близо до радиалния ръб, и Б) на дисталната част на аналния канал с инфилтрация на перианални мускули.
Нарушена и инфилтративна тубуларна жлезиста пролиферация, подлежаща на не-неопластична сквамозна анална лигавица при ендоскопска биопсия на ADC на аналните жлези (хематоксилин и еозин × 10).
А) Субмукозен неопластичен жлезист компонент в ADC на аналните жлези (хематоксилин и еозин × 20). Б) ADC на аналните жлези с положителна имуноекспресия в жлезите за CK7 (цитокератин 7 × 10). В) ADC на аналната жлеза отрицателен за CK20 (цитокератин 20 × 10). D) CDX2 отрицателен ADC на аналната жлеза (CDX2 × 10).
И накрая, ADC, свързан с хронични колоректални фистули (вродени или придобити), с продължителна еволюция (10-20 години), обикновено е вторичен за хроничните възпалителни процеси като болестта на Crohn или други еволюирали доброкачествени перианални заболявания. Понякога фистулите са вторични за дилатацията на жлезите на аналния канал или неговите канали, а морфологията и имунохистохимията на тумора биха били идентични с тези на ADC на аналната жлеза/канал. Джоунс и Морсън 9 предполагат, че някои от тези свързани с фистула карциноми произхождат от вродени дублирания на дисталния край на задното черво (задно черво). Като цяло те приемат добре диференциран муцинозен ADC модел, но точният хистогенетичен произход често е невъзможно да се демонстрира и може да принадлежи към някой от предходните подтипове. Освен това, той трябва да бъде разграничен от ADC на ректума с ниско съдържание на муцин. В този смисъл имунохистохимичното изследване (CK20, CK7 и CDX2) може да бъде променливо и само чрез комбиниране на морфологични, имунофенотипични и клинично-еволюционни характеристики може да се счита за един или друг произход 2,4,5,7–9 .
Аналните тумори са редки новообразувания на стомашно-чревния тракт, представляващи 5% от всички аноректални новообразувания и 1,5% от стомашно-чревни тумори. Микроскопичните следи в туморите на аналния канал постепенно се променят през годините. Нарастващият опит и подкрепа от имунохистохимични техники и молекулярни изследвания доведоха до множество промени в номенклатурата. Най-честата лезия, както на аналния канал, така и на перианалната кожа, е плоскоклетъчният карцином, който представлява между 70% и 80% 10–13. Аналният ADC представлява около 10% от всички злокачествени анални лезии (5-19%): той има по-агресивна естествена история от плоскоклетъчния карцином с по-ниска преживяемост и по-висока честота на рецидиви, както локални, така и отдалечени 2,6,10, 13– 15 .
Въпреки че са описани добри резултати при пациенти с новообразувания, които се откриват в ранните еволюционни етапи, клиничното сходство с други доброкачествени заболявания и по-ниската експресия на туморния компонент в лигавицата обикновено са причини, които забавят диагнозата и следователно обедняват прогнозата 16. Пациентите с ADC на аналния канал присъстват в по-висок процент с напреднало заболяване, отдалечени метастази и следователно по-ниска обща преживяемост срещу плоскоклетъчен карцином. Данните от Националната база данни за рака (NCDB) разкриват, че 9,8% от пациентите с анален ADC са стадий IV при представяне, в сравнение с 5% от сквамозните карциноми. По същия начин, отдалечени лезии се срещат при 28,1% от пациентите с ADC в сравнение с 11,8% от сквамозните. Степента на 5-годишна преживяемост при пациенти с ADC е по-лоша във всички етапи от тази при пациенти с плоскоклетъчен карцином, като се потвърждава по-голяма разлика в стадий IV (13% за пациенти с ADC и 29% за тези с плоскоклетъчен карцином.) Петнадесет. .
Възрастта на представяне е около шестото десетилетие от живота, с равно разпределение по пол 3.14. Предложени са множество рискови фактори като HPV и HIV, тютюн и имуносупресия 10,17. Наличието на хронични перианални фистули, свързани или не с болестта на Crohn, е важен рисков фактор, особено когато те надвишават 10-годишна история 17,18. Lymphogranuloma venereum (LGV), като причина за проктит, може да причини стеноза и перианални фистули и също е свързан с повишен риск от ректален ADC 19 .
Клиника и диагностика
Клиничните прояви обикновено са неспецифични. Пациентите могат да имат болка, втвърдяване, абсцеси, фистули или осезаема маса. Други симптоми включват кървене, сърбеж, зацапване, пролапс и загуба на тегло 6,13. В поредицата от Kline et al. 20, 15% от пациентите са били безсимптомни. Типично е наличието на перианална фистула с повече от 10 години еволюция или наличието на повтарящи се фистули дори след операция 6 .
Ранното подозрение за диагностика е от решаващо значение, за да се избегне забавяне на диагностиката и лечението. Въпреки че клиничните характеристики могат да ни накарат да подозираме този тип тумор, окончателната диагноза може да бъде установена само чрез биопсия и хистологично изследване. При напреднала фистулна болест не е ясно дали биопсията трябва да се вземе от аналния канал близо до вътрешната ос или чрез кюретаж на външната ос 17 .
В допълнение, ингвиналните аденопатии трябва да бъдат изследвани, тъй като, както беше посочено по-горе, те са агресивни лезии с висока способност за локална и далечна инвазия. Локалното разпространение има тенденция да бъде по-голямо при тези тумори, произхождащи от жлезите на аналния канал или свищевите пътища, тъй като, разположени извън чревната стена, разпространението започва от по-напреднала позиция.
Други диагностични методи за изследване на неговото локално и далечно разширение включват ендоаналния ултразвук, тазовия магнитен резонанс и компютърната томография 17,18 .
Оскъдната публикувана казуистика на ADC на аналния канал предполага, че няма напълно доказана терапевтична схема. До 90-те години на миналия век повечето автори препоръчват радикална операция (абдоминоперинеална ампутация [AAP]) като избрано лечение за ADC на аналния канал 21–23 .
В ретроспективен анализ на 192 пациенти с рак на аналния канал, лекувани в Университета на Минесота, Klas et al. 24 описват своя опит с 36 пациенти, диагностицирани с ADC. Двадесет и двама (61%) бяха лекувани само с операция (6 PAAs и 16 локални резекции) и 14 (39%) с операция, последвана от химиорадиотерапия (CRT). 5-годишната преживяемост и локалният рецидив са съответно 63 и 21%. Те не сравниха терапевтичните модалности помежду си поради недостатъчния брой пациенти. Те отдават добрите резултати на факта, че повечето лезии (78%) са по-малки от 5 cm и защитават лечението с преди или следоперативна CRT за по-големи лезии (> 5 cm).
Ретроспективно мултицентрово проучване, което включва 82 пациенти, диагностицирани с анален ADC, лекувани в различни европейски центрове 3, препоръчва комбинирана CRT като най-доброто лечение, запазвайки радикалната операция (PSA) само като спасяване. В това проучване пациентите са били управлявани с комбинирана CRT, лъчетерапия (RT) плюс хирургическа интервенция или само операция. Общата преживяемост и без заболяване е по-висока при тези пациенти с CRT, в сравнение с тези с RT плюс операция или само операция. Многовариантният анализ показа, че стадий Т и N, хистологична степен и терапевтична модалност са независими прогностични фактори за оцеляване. Това проучване обаче има доста недостатъци: неоадювантната терапия не е била използвана в никоя група, адювантната химиотерапия не е била използвана след операция, пациентите, които са влезли в RT и хирургичната група, са били значително по-възрастни от пациентите в комбинираната CRT група и в 75 % от оперираните пациенти са подложени на локална резекция. Тези фактори могат да бъдат отговорни за високата степен на локален и отдалечен рецидив в групата с RT и операция.
Папагикос и др. 15 са изследвали 16 пациенти с анален ADC, които са били лекувани с RT със или без химиотерапия с лечебно намерение. Резултатите от това лечение са сравнени с група пациенти с плоскоклетъчен карцином, лекувани с CRT. Средното проследяване е 45 месеца за пациенти с ADC и 44 за тези с епидермоид. Въпреки че пациентите с плоскоклетъчен карцином са имали по-напреднали първични тумори, локалните и отдалечени рецидиви са значително по-високи при пациенти с ADC. Освен това, 5-годишната преживяемост без заболяване след CRT е била 19% при пациенти с ADC в сравнение с 77% при тези с плоскоклетъчен карцином. Това проучване заключава, че окончателното CRT лечение, което се е оказало полезно при плоскоклетъчни тумори, има лош локален контрол и голям брой отдалечени рецидиви при пациенти с ADC. Те препоръчват предоперативна CRT, последвана от AAP, за да се постигне максимален контрол на таза на заболяването. Адювантна химиотерапия може да се обмисли при микрометастатично заболяване.
Ретроспективно проучване на Li et al. 25, който включва 49 пациенти с ADC на аналния канал, заключава, че AAP заедно с CRT е препоръчителното лечение. 5-годишната преживяемост при пациенти само с APA, CRT, APA плюс CRT и без лечение е била съответно 34,4, 0, 37,5 и 0%.
Chang et al. 6 показват поредица от повече от 20 години опит в тяхната поредица от 34 пациенти, при които потенциално излекуващите се лекуват чрез локална хирургия, последвана от RT или CRT, или радикално хирургично лечение (PSA) плюс пред- или следоперативна CRT. Преживяемостта без заболяване е била 13 месеца след локална резекция и 32 месеца след радикална операция, а 5-годишната обща преживяемост е била 43% за локално лечение и 63% за пациенти, лекувани с радикална операция (Таблица 1).
- Некардиолни аспекти; gicos на стеноза a; rtica в m; s по-възрастни; Прегледах; n Испанско списание
- Операция за брахиопластика за намаляване на контура на ръцете
- Бритни Спиърс екстремна пластична хирургия, която промени лицето й
- Около 40% от испанското възрастно население е с наднормено тегло и 21% са със затлъстяване
- ЗЕРНОВИ - Испанска асоциация на производители на зърнени култури