Обобщение
Достъпът е предоставен от
Главен
Основните ограничения на вирусните вектори, особено тези, свързани с безопасността и имуногенността, доведоха до проучвания за подобряване на невирусните методи за доставка на гени. 1 Сред такива невирусни вектори, катионните липозоми са една от най-обещаващите невирусни системи за използване в генната терапия. 2 Ефективното доставяне на функционални терапевтични гени в целевите клетки е основен проблем в подходите за генна терапия за лечение на рак и метаболитни заболявания, както и инфекция с вируса на човешка имунна недостатъчност.
Предполагаме, че електростатичното взаимодействие на катионни SG липозоми с ДНК не е било достатъчно, за да позволи образуването на липозомен/ДНК комплекс с малък размер на частиците. Следователно, ние проектирахме силно положително заредени липозоми с малък размер, които след смесване с водна фаза, съдържаща ДНК, могат да бъдат заредени с ДНК, което води до образуването на малък комплекс липозома/ДНК. За селекция на черния дроб ние приготвяме липозоми, съдържащи β-ситостерол β-D-глюкозид (Sit-G), който е основният компонент на SG (Sit-G липозоми). За да увеличим положителния заряд в липозомите, избрахме реагент Tfx-20 (Tfx) и 3β [N - (N ', N' -диметиламиноетан) -карбамоил] холестерол (DC-Chol) като катионни липиди, тъй като първият е синтетично катионно липидно съединение [[N, N, N ', N' -тетраметил-N, N '-бис (2-хидроксиетил) -2,3-ди (олеоилокси) -1,4-бутандиамониев йодид], провеждащо при високи нива Ефективността на трансфекцията в клетъчните линии 13 и последната вече се използва клинично за генна терапия. 14, 15 За да приготвим малки липозоми, използваме модифицирания метод за инжектиране на етанол.
В това проучване ние подготвяме малки високо положително заредени Sit-G липозоми, оптимизираме съотношението на плазмидната ДНК, кодираща луциферазния репортерен ген към Sit-G липозомите, като оценяваме ефективността на трансфекцията в HepG2 клетки в присъствието на серум в средата и изследва генната експресия на Sit-G DNA/липозомния комплекс след интравенозно инжектиране при мишки.
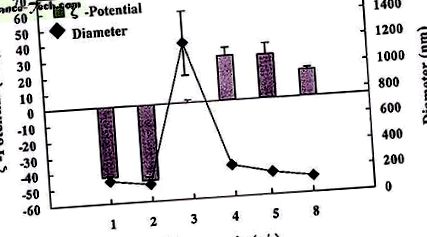
Показано е, че липозомите Sit-G (78 ± 2 nm) с висок потенциал от .8 положителни (33.8 ± 7.0 mV) имат кръгла форма чрез микроскопско наблюдение (данните не са показани). Липозомната суспензия Sit-G е много стабилна и може да се съхранява няколко месеца при 4 ° C без промяна в размера на частиците (данните не са показани). Размерът на частиците и потенциалът на липозомните/ДНК комплекси Sit-G зависят от съотношението на зареждане (+/-) на катионния липид към ДНК (Фигура 1). При съотношение на заряд (+/-) от приблизително 3, се наблюдава най-големият среден размер на частиците и дисперсия на комплекса (1200 ± 247 nm), когато потенциалният подход се приближава приблизително до нула (0,1 ± 0,3 mV). С изключение на съотношението на зареждане от 3, размерът на частиците на липозомния/ДНК комплекс е в диапазона от приблизително 100-250 nm.
Изображение в пълен размер
За да се оптимизира съотношението на ДНК към Sit-G липозоми, експресията на репортерния ген беше изследвана в HepG2 клетки, трансфектирани със Sit-G липозоми при различни съотношения на натоварване (+/-) в среда със или без серум (Фигура 2). Съотношението на натоварване (+/−), свързано с по-високата ефективност на трансфекция на липозома/ДНК комплекс Sit-G, беше променено от 3 на 4 чрез добавяне на 10% серум към средата. При инкубация в продължение на 1 h в среда, съдържаща серум, размерът на частиците на липозомния/Sit-G ДНК комплекс при съотношение на натоварване (+/−) 4 се увеличава от 240 ± 16 nm до приблизително 3 μm, а потенциалът de намалява от 27,9 ± 5,1 mV до -8,9 ± 2,1 mV. Различни компоненти на серума, като говежди серумен албумин (BSA), хепарин, имуноглобулин G и липопротеини променят потенциала на липозомния/ДНК комплекс от положителен към отрицателен или неутрален. 16, 17 Следователно, липозомният/ДНК комплекс в серум-съдържаща среда може да изисква излишен положителен заряд, което води до увеличаване на съотношението на зареждане (+/-) за висока ефективност на трансфекция от 3 до 4.
Експресия на гени в HepG2 клетки, трансфектирани със Sit-G липозоми, не-Sit-G липозоми или Tfx/ДНК комплекси в среда със или без 10% серум. Аликвотите от 2 µg плазмидна ДНК (pAAV-CMV-luc) се комплексират с всеки тип липозома или Tfx частици при съотношение на зареждане (+/-) от 4 и 2, съответно. Tfx/ДНК комплексите се приготвят като контроли със и без ДНК при съотношение на натоварване (+/-) 2 (2 μg ДНК с 0,06 mg/ml от общите липиди, съответно 0,015 mg/ml от катионни липиди), съгласно производителите. Протокол (Promega). Липозомите, които не са Sit-G, съставени от Tfx/DC-Chol (1,3/2, тегловно съотношение), са получени чрез модифициран метод на инжектиране на етанол, както е описано в легендата към Фигура 1. Други експериментални условия са идентични с описаните в легендата Фигура 2. Всяка колона представлява средната стойност ± SD (n = 3). *** Р
Дозова зависимост на генната експресия на 24 h след интравенозно инжектиране на Sit-G липозома, комплексирана с плазмидна ДНК при мишки. Съотношението на зареждане (+/-) на катионния липид към плазмидната ДНК (pAAV-CMV-luc) е 4. Експерименталният протокол е идентичен с този, описан в легендата на Фигура 4. Всяка колона представлява средната стойност ± SD (n = 4 ). (□) 30 µg ДНК; (▪) 50 µg ДНК; (░) 100 μg ДНК.
Изображение в пълен размер
Sit-G липозомите изглеждат потенциално полезни вектори за насочване на черния дроб, които показват ефективност, подобна на тази на галактозил лиганда, въпреки че е необходимо да се изясни дали генната експресия в черния дроб е селективна за паренхимни или непаренхимни клетки. Двадесет и четири часа след интравенозно инжектиране на не-Sit-G липозомен/ДНК комплекс в доза от 50 ug ДНК, една от петте мишки умира. Това може да се дължи на токсичност, причинена от агрегати от комплекса в серума, както се предполага от наблюдението, че комплексът, който не е Sit-G липозома/ДНК, е по-голям от комплекса Sit-G липозома/ДНК в среда, която съдържа серум (Фигура 6 ). Това откритие предполага, че добавянето на Sit-G към липозомите може да доведе до добра дисперсия на липозомния/ДНК комплекс в серума.
Сканиране на електронни микрографии на Sit-G ДНК/липозомни комплекси (а) и не-Sit-G ДНК/липозомни комплекси (b) след инкубация за 1 час с 10% серумна среда. Съотношението на зареждане (+/-) на катионния липид в липозомите към плазмидната ДНК (pAAV-CMV-luc) е 4. Плазмидната ДНК (2 ug) се смесва и инкубира в продължение на 15 минути при стайна температура с липозомите във вода и след това за 1 час в среда с 10% серум при 37 ° С. Методът, използван за визуализиране на липозомни/ДНК комплекси, е адаптиран от Sternberg et al. Накратко, 10 µl аликвоти от прясно приготвени проби бяха поставени върху медната платформа и покрити с покривно стъкло, върху което се образува един слой липозомен/ДНК комплекс. Слоят беше замразен и изсушен. След отстраняване на покриващото покритие слоят липозома/ДНК на медната платформа беше покрит със злато и разгледан със сканиращ електронен микроскоп (SEM) (JSM-T200; JEOL, Токио, Япония).
Изображение в пълен размер
В заключение ние успешно подготвихме малки Sit-G-липозомни/ДНК комплекси с диаметър приблизително 200 nm при pH 7 за доставяне на гени, насочени към черния дроб. Комплектът Sit-G-липозома/ДНК значително повишава ефективността на трансфекция в HepG2 клетки при съотношение на натоварване (+/-) 4 с добавяне на 10% серум към среда, което показва селективна генна експресия в черния дроб след интравенозно инжектиране в мишки, което предполага че взаимодействието на липозомни/ДНК комплекси със серума може да бъде ключов момент за прогнозиране на in vivo ефикасността на липозомния вектор.
Sit-G липозомите ще бъдат полезни като вектори за доставяне на чернодробни гени чрез допълнителни подобрения, като добавяне на фузогенен пептид към липозомата за увеличаване на освобождаването на сложна ДНК в цитозола и оптимизиране на условията за образуване на комплекс. И дозата на липидите.
Израз на благодарност
Бихме искали да благодарим на професор T Tsuji и неговата изследователска група в Катедрата по микробиология в Университета Hoshi за тяхното съдействие при подготовката на плазмиди и доцент J Kamei и неговата изследователска група в Катедрата по фармакология в University of Hoshi за неговото съдействие в анализ на луцифераза. Също така бихме искали да благодарим на д-р J Wang за съдействието в експерименталната работа. Тази работа бе подкрепена отчасти от фондацията Tokyo Nagai Foundation и грант за научни изследвания от Министерството на образованието, науката, спорта и културата, Япония, 12672210.