Субекти
Обобщение
Въведение
Аторвастатин е понижаващо холестерола лекарство, което обикновено се използва за лечение на хиперхолестеролемия. Той инхибира 3-хидрокси-3-метилглутарил-коензим А редуктаза (HMG-CoA), ензимът, който катализира ограничителния етап на синтеза на холестерол 11. Доколкото ни е известно, нито едно публикувано проучване не е свързало променен ГМ с лечение с аторвастатин в HFD-индуциран модел на хиперхолестеролемичен плъх. Целта беше да се изследва как ММ реагира на индуцирано от аторвастатин намаляване на нивото на холестерола в модел на HFD-индуциран хиперхолестеролемичен плъх. По-специално, ние се опитахме да открием дали медикаментозното лечение може да повлияе на състава и разнообразието на ГМ при хиперхолестеролемични плъхове спрямо здравите контроли.
Резултати
Хиперхолестеролемия и анализ на фармакологичните лечения.
Хиперхолестеролемията е потвърдена 5 седмици след HFD хранене чрез повишени нива на серумен холестерол. Нива на холестерол (P 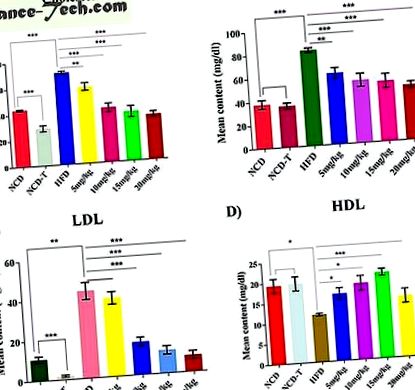
Относителното изобилие се изразява като процент от доминиращата и/или често присъстваща бактериална фила сред различните диети и групи, лекувани с лекарства. Граничните точки за избор на доминираща фила бяха определени на ≥1% и често присъстващите таксони бяха открити при> 50% от плъховете на група. NCD, нормална диета с чау; NCD-T, нормална чау диета + лечение с аторвастатин; DFH, диета с високо съдържание на мазнини; 5 mg/kg, HFD + 5 mg/kg аторвастатин; 10 mg/kg, HFD + 10 mg/kg аторвастатин; 15 mg/kg, HFD + 15 mg/kg аторвастатин; 20 mg/kg, HFD + аторвастатин 20 mg/kg.
Изображение в пълен размер
Промяна на чревната микробиота в отговор на HFD.
Дозозависима промяна на таксоните в групи, лекувани с аторвастатин, спрямо контролите
Относителното изобилие от протеобактерии се увеличи значително (P
Многовариантният анализ на основните координати на състава на микробните съобщества между различните групи. PCoA се извършва от последователности на ниво OTU с> 97% сходство, като се използва непретеглената метрика за разстояние UniFrac. NCD, нормална диета с чау; NCD-T, нормална чау диета + лечение с аторвастатин; DFH, диета с високо съдържание на мазнини; 5 mg/kg, HFD + 5 mg/kg аторвастатин; 10 mg/kg, HFD + 10 mg/kg аторвастатин; 15 mg/kg, HFD + 15 mg/kg аторвастатин; 20 mg/kg, HFD + аторвастатин 20 mg/kg.
Изображение в пълен размер
Анализ на алфа разнообразието на последователността на четене. ( ДА СЕ ) Експериментално наблюдавани криви на разреждане на OTU спрямо ( Б. ) изчислено от Chao1. ( ° С ) Биоразнообразието, оценено от индекса на Шанън. NCD, нормална диета с чау; NCD-T, нормална чау диета + лечение с аторвастатин; DFH, диета с високо съдържание на мазнини; 5 mg/kg, HFD + 5 mg/kg аторвастатин; 10 mg/kg, HFD + 10 mg/kg аторвастатин; 15 mg/kg, HFD + 15 mg/kg аторвастатин; 20 mg/kg, HFD + аторвастатин 20 mg/kg.
Изображение в пълен размер
Както при лекуваните с лекарства групи с HFD, относителното изобилие на филопротеобактериите, семействата (Porphyromonadaceae, Desulfovibrionaceae и Helicobacteraceae) и рода Helicobacter се увеличава в групата с NCD-T в сравнение с контролната група с NCD-T. В допълнение, Clostridiaceae, Lachnospiraceae, Spirochaetaceae и Eubacteriaceae показват значително увеличение в групата с NCD-T в сравнение с контрола на NCD (допълнителна таблица 2). По същия начин родовете Treponema, Lachnoclostridium, Barnesiella, Ruminococcus, Eubacterium, Desulfovibrio и Roseburia също се увеличиха в групата с NCD-T. Докато сред доминиращите родове, относителното изобилие на Oscillospira, Prevotella, Bacteroides и Parabacteroides намалява в групата с NCD-T в сравнение с контрола на NCD (Допълнителна таблица 3).
Съотношения между половете и нивото на холестерола.
Корелацията на половете с нивото на холестерола се извършва с помощта на непараметричния корелационен анализ на Spearman. Установено е, че доминиращите таксони, които са били променени в групите с NCD-T, HFD, 5 mg/kg, 10 mg/kg, 15 mg/kg и 20 mg/kg, са свързани с различни холестероли. Родовете, които са били в отрицателна корелация с LDL (ρ> -0,17), TG (ρ> -0,14) и нивата на холестерола (ρ> -0,27), включват Clostridium, Desulfovibrio, Roseburia, Blautia, Helicobacter, Ruminococcus и Lactobacillus (Фиг. 5). ). Установено е обаче, че Prevotella, Coprococcus, Prevotella [YRC22], Paraprevotella, Clostridia [SMB53] и Dorea имат положителна корелация с нивата на LDL (ρ> 0,2), TG (ρ> 0,1) и холестерола (ρ> 0,26). (Фиг. 5). По същия начин Oscillospira (ρ> 0,33) показва положителна корелация с нивото на HDL (Фиг. 5).
Лечението с аторвастатин в групата с HFD увеличава относителното изобилие от родовете Bacteroides и Parabacteroides. Bacteroides и Parabacteroides са имали максимално количество в доза от 10 mg/kg и 15 mg/kg, съответно. По същия начин, администрирането на влакна от червена боровинка на апоЕ -/- мишки, хранени с HFD, повишава нивото на Bacteroides и Parabacteroids заедно с намаляване на нивото на TG. Бактероидите са свързани с метаболизма на жлъчните киселини и насърчават деконюгацията на жлъчните киселини, конюгирани с таурин, присъстващ в серума 18, 33. Диетата с високо съдържание на холестерол/холева киселина модифицира състава на фекалните жлъчни киселини 34 и променената жлъчна киселина се свързва с дисбиоза 35. Нивото на Desulfovibrio (произвеждащи ендотоксини и редуциращи сулфат бактерии) 36, 37 показва увеличение на относителното изобилие в групата с NCD-T.
По същия начин родът Parabacteroides, включващ 38 противовъзпалителни бактерии, показва постоянно нарастване на относителното изобилие при различни дози аторвастатин в групата с HFD. Руминококи (бактерии, продуциращи триптамин) 39 показват потиснато ниво при лечение с аторвастатин на плъхове, хранени с HFD. Родът Oscillospira, който включва видове 40, произвеждащи бутират, показва постоянно нарастване на групите, лекувани с HFD, лекувани с лекарства. Лечението с рапамицин (регулатор за консумация и съхранение на енергия) при индуцирани от HFD плъхове със затлъстяване води до повишено изобилие от Turicibacter 41. В нашето проучване е установено намаляване на нивото на Turicibacter при групи, лекувани с наркотици с HFD. По същия начин Clostridium (произвеждащи бутират таксони) 42 показва намалено ниво в групата, лекувана с лекарството. Според нашите резултати Di Lucci et. Ал съобщава за повишено изобилие от копрокок в метаболитния синдром, предизвикан от диета, богата на фруктоза при модел на затлъстели плъхове 43 .
Catry et al. съобщава за повишаване нивото на Lactobacillus видове след приложение на езетимиб и симвастатин при мишки, хранени с NCD 7. Наблюдавахме увеличаване на относителното изобилие на Lactobacillus в групата с NCD-T. Понижаващата холестерола способност на бактериите от рода Lactobacillus е демонстрирана по-рано чрез прилагането на Lactobacillus reuteri LR6, Lactobacillus reuteri NCIMB 30242 и Lactobacillus johnsonii BS15 при хиперхолестеролемични плъхове и пациенти и при миши модел с безалкохолна чернодробна недостатъчност, черен дроб 4444, 45. Потенциалната способност за понижаване на холестерола на видовете Lactobacillus се нуждае от повече изследвания, за да се установи точната му роля в метаболизма на холестерола. Опитахме се да свържем нивото на холестерола при плъхове и относителното изобилие от потенциални холестерол-понижаващи бактерии по време на лечението с аторвастатин. Ограничение на нашето проучване беше липсата на метаболомични данни. Използването на този инструмент може да осигури подробна връзка между състава на серумните метаболити и микробиома в контекста на лечението с аторвастатин.
Като цяло това проучване подчерта въздействието на аторвастатин върху ГМ от модел на HFD контролно животно. По-специално, приложението на аторвастатин увеличава бактериалното разнообразие и обръща относителното изобилие на няколко доминиращи таксона, които са модифицирани от HFD към фенотипа на NCD. Лечението с аторвастатин също води до специфичен ефект на лекарството върху разпределението на популацията на някои бактерии в групите HFD и NCD-T, лекувани с лекарството. Различните класове лекарства за понижаване на холестерола могат да предизвикат променливи ефекти върху чревния микробиом и да осигурят потенциална връзка между състава на ГМ, нивото на холестерола и лекарствената терапия. В заключение, лекарствата за понижаване на холестерола, които обикновено се предписват по време на хиперхолестеролемия, трябва да бъдат претеглени за модифициращи ефекти върху микробиомите, които могат да имат важни последици за здравето на гостоприемника.
Материал и реактиви
Животински модел и лечение.
Четиридесет и две специфични без патогени плъхове Wistar (100–120 g) бяха предоставени от Дома за животни от Департамента по биохимия, Университет Крал Абдулазиз, Джеда, Саудитска Арабия. HFD съдържа 3% холестерол (Sigma Aldrich Co., USA), 0.2% холева киселина (Sigma Aldrich Co., USA), 15% говежди лой и 81, 8% от нормалните фуражи. Всички добавени компоненти са взети като процент от общата диета. Аторвастатин (Pfizer Inc., САЩ) се използва като лекарство за понижаване на холестерола 47. Всички експерименти с животни в това проучване са проведени в съоръжението за животни на Департамента по биохимия, Факултет на науките, Университет Крал Абдулазиз. Протоколът за изследване е одобрен от комитета за изследване на етиката на Медицинското училище на крал Абдулазиз под номера на споразумението (регистрационен номер HA-02-J-008). Експериментът е проведен в съответствие с одобрените насоки.
Плъховете се приспособяват към стандартизираните параметри на околната среда на дома за животни в продължение на 7 дни, включително температура (21 ± 1 ° C), относителна влажност (60 ± 10%) и 12-часов цикъл ден-нощ. Условията на околната среда в дома на животните се поддържат до края на експеримента. Първоначално 42-те плъхове бяха разделени на случаен принцип в две групи и хранени или с нормална диета чау (NCD; n = 12), или с диета с високо съдържание на мазнини (HFD; n = 30). Хиперхолестеролемията е потвърдена след 5 седмици лечение с HFD. От групата с NCD, шест плъха са третирани с доза от 10 mg/kg/d аторвастатин (NCD-T), докато останалите шест плъха са държани като NCD контроли. В HFD-индуцираната хиперхолестеролемична група шест плъха служат като HFD контроли, а останалите 24 плъха се разделят на четири равни групи и се третират с различни концентрации на аторвастатин (5, 10, 15 или 20 mg/kg/d). Аторвастатин се суспендира в изчислено количество стерилна дестилирана вода с помощта на магнитна бъркалка и лекарството се прилага интрагастрално веднъж на всеки 24 часа, като се използва катетърна тръба 47. Животните са лекувани с аторвастатин в продължение на 28 дни.
Вземане на проби от кръв и тъкани и анализ на нивата на холестерола.
Взети са кръвни проби от орбиталния плексус два пъти: на 5 седмици за потвърждаване на хиперхолестеролемия в групата с HFD и преди жертва за оценка на ефекта от медикаментозното лечение върху нивото на холестерола в изследваните групи. Серумът се изолира от кръвни проби чрез центрофугиране при 3000 об/мин при 4 ° С за 15 минути. Липидният профил, включително серумен LDL, холестерол, TG и HDL, се анализира с автоматизиран биохимичен анализатор (Aeroset 09D0501, American). Съдържанието на цекума се събира от всички животни веднага след умъртвяването и се съхранява при -80 ° C за изолиране на ДНК.
16S rRNA секвениране и обработка на данни
Метагеномната ДНК се извлича от цекалното съдържание с помощта на AccuVisBio ДНК екстракционен комплект за изпражнения (AccuVisBio, Абу Даби) в съответствие с инструкциите на производителя и концентрацията на ДНК се измерва с помощта на системата Qubit (Invitrogen, САЩ). Пробите бяха секвенирани за 16 S rRNA гени, насочени към V3-V4 региона с универсални 341 F и 785 R праймери за баркод, следвайки процедурата на Dowd et al. 48. Чрез ограничен PCR цикъл, баркодове с двоен индекс Illumina и адаптери за секвениране бяха използвани за свързване на четенията. След пречистване с топчета Agencourt AMPure (Agencourt, САЩ), библиотеките бяха нормализирани, използвайки протокола Nextera XT. Пробите се обединяват в единична поточна клетка за секвениране на платформата за секвениране MiSeq (Illumina, Сан Диего) следвайки протокола на производителя. Автоматизираното генериране на клъстери и сдвоеното крайно секвениране с четения с двоен индекс бяха извършени в едно изпълнение с дължина на четене 2 x 300 bp.
Сдвоените окончателни четения бяха събрани с помощта на PANDAseq, а суровите FASTQ файлове бяха получени от Illumina MiSeq 49. Грундовете и баркодовете бяха премахнати от последователностите. Всички се четат с „N“ и тези с последователности 50. Почистените последователности се обединяват при k = 10 (97% сходство), последвано от отстраняване на химери и единична проба 51,52. И накрая, OTU бяха класифицирани с помощта на QIIME 1.9 спрямо подбрана база данни, получена от GreenGenes 53. Данните за последователността на това проучване са достъпни в Европейския архив на нуклеотидите по проект №. PRJEB23060.
статистически анализ
Биоразнообразието и богатството на OTU бяха изчислени с помощта на QIIME 1.9, реализиран с непараметричен анализ Chao1 и анализ на разреждането, който показа еднородността и разпределението на OTU в различните групи. Данните бяха нормализирани до равен брой четения на проба и PCoA беше извършен от последователности на ниво OTU с> 97% сходство, използвайки нетеглен метричен показател за разстояние UniFrac. Графиката на PCoA беше разгледана от ИМПЕРОРА. Бяха извършени еднопосочни ANOVA (за параметрични данни) и Kruskal-Wallis и Mann-Whitney (за ненормални данни) непараметрични тестове за идентифициране на значително различни бактериални таксони между различните групи, докато беше използван тестът Kolmogorov-Smirnov D. за определяне на нормалността на данните. За статистически анализ се използва SPSS версия 16. Различията в нивата на холестерол между контролните и лекуваните групи бяха анализирани чрез t-тест на Student (два опашка), използвайки GraphPad Prism версия 6.01 (Graph Pad Software, Сан Диего, САЩ), а значителните разлики бяха посочени като * P
- Излишъкът от сол в храната уврежда чревната микробиота
- Чревна дисбиоза - чревна микробиота Барселона
- Две много често срещани емулгатори променят чревната микробиота на мишките • Тенденции21
- Ефект от приложението на бета-циклодекстрин в диетата върху липидния профил на плъхове
- Открийте как чревната микробиота регулира кръвното налягане
