Обобщение
Цел:
Инхибирането на ангиотензин конвертиращия ензим (АСЕ) може да намали телесното тегло на мишки, които са на диета с високо съдържание на мазнини. Настоящото проучване изследва ефекта на ACE инхибитора, каптоприл (CAP), върху обръщането на диета, индуцирано затлъстяване (DIO), инсулинова резистентност и възпаление при мишки.
Материали и методи:
DIO се произвежда при мъжки мишки C57BL/6J (n = 30) чрез поддържане на животните на диета с високо съдържание на мазнини (тегло/тегло 21% мазнини) в продължение на 12 седмици. През следващия 12-седмичен период на лечение на животните беше разрешен достъп до диета с високо съдържание на мазнини и вода, съдържаща CAP (0,05 mg ml-1) или обикновена чешмяна вода (CON, контрол).
Резултати:
От първата седмица на лечение, приемът на храна и телесното тегло намаляват при третирани с ОСП мишки в сравнение с CON мишки. Както периферната инсулинова чувствителност, така и чернодробната инсулинова чувствителност са подобрени при третирани с CAP мишки в сравнение с CON мишки. Лекуваните с CAP мишки са намалили абсолютното и относително тегло на черния дроб и епидидималната мазнина в сравнение с CON мишките. Лекуваните с CAP мишки са имали по-високи плазмени адипонектин и по-ниски плазмени нива на лептин в сравнение с CON мишки. В сравнение с CON мишки, третирани с CAP мишки са имали намаляване на скелетния и мастния мускул моноцитен хемоаттрактант протеин 1 (MCP-1), мастния интерлевкин-6 (IL-6), рецептор 4 подобен на таксата (TLR4) и несвързан протеин 2 ( UCP2) mRNA изрази. В допълнение, лекуваните с CAP мишки повишават активирания от пероксизома пролифератор γ коактиватор-1α (PGC-1α), дълговерижната ацил-CoA дехидрогеназа (LCAD), хормоночувствителната липаза (HSL) и липазата. Намален липопротеин (LPL) . Черният дроб.
Завършеност:
Резултатите от настоящото проучване показват, че при DIO мишки лечението с ОСП намалява приема на храна и телесното тегло, подобрява чувствителността към инсулин и намалява експресията на иРНК за възпалителни маркери. По този начин ОСП може да бъде жизнеспособно лечение за затлъстяване, инсулинова резистентност и възпаление.
Въведение
Затлъстяването се превръща в основната епидемия на 21 век, главно в развитите страни, въпреки че сега е призната в световен мащаб. Приблизително 1,6 милиарда възрастни по света са с наднормено тегло и 400 милиона отговарят на критериите за затлъстяване. 1 Затлъстяването е свързано с редица други заболявания, включително диабет тип 2, сърдечно-съдови заболявания и някои видове рак. 2 Често възникваща връзка е хроничното системно възпаление. При слаби индивиди адипоцитите секретират невъзпалителни или противовъзпалителни фактори, като интерлевкин (IL) -10 или IL-13 или сенсибилизиращи инсулина фактори. 3 Когато индивидите затлъстяват, макрофагите започват да се натрупват в мастната тъкан и водят до локално възпаление. С увеличаване на затлъстяването в мастната тъкан се произвеждат различни провъзпалителни фактори. Всъщност мастната тъкан на затлъстели индивиди показва по-висока експресия на провъзпалителни протеини, включително IL-6, фактор на туморна некроза-α (TNFα) и моноцитен хемоаттрактант протеин-1 (MCP-1), в сравнение с индивиди. Четири пет
Хроничното активиране на вътреклетъчните провъзпалителни пътища в инсулиновите целеви клетки може да доведе до свързана със затлъстяването инсулинова резистентност. 6 Активирането на макрофаги, свързано със затлъстяването, води до увеличаване на производството на провъзпалителни медиатори като TNFα, IL-1β и резистин, които действат върху адипоцитите, за да индуцират състояние на инсулинова резистентност. 7 Освен това, отрицателните корелации, наблюдавани между TNFα и липопротеиновия холестерол с висока плътност, гликозилирания хемоглобин и концентрациите на серумен инсулин, обясняват защо коронарната артериална болест е по-често при пациенти със затлъстяване в сравнение със здрави или слаби индивиди. 8
Инхибиторите на ангиотензин конвертиращия ензим (АСЕ) се използват широко като лечение на първична хипертония. АСЕ инхибиторите инхибират образуването на ANG-II и следователно понижават кръвното и венозното налягане. 19 Действията на инхибирането на АСЕ надхвърлят регулирането на кръвното налягане и подобрения в инсулиновата активност на цялото тяло са докладвани при многобройни инсулиноустойчиви модели на гризачи след лечение с АСЕ. 20, 21 Освен това, АСЕ инхибиторите или блокерите на ангиотензиновите рецептори намаляват както телесното тегло, така и телесните мазнини. 22, 23 Доказано е, че ACE инхибиторът каптоприл (CAP) предотвратява развитието на затлъстяване при гризачи, хранени с диета с високо съдържание на мазнини, 22, 24, въпреки че механизмите остават неразрешени. Напоследък се спекулира, че антиоксидантните и противовъзпалителни свойства на ОСП могат да допринесат за подобряване на телесното тегло. 25
Резултати
Телесно тегло, телесен състав и прием на течности и храна.
След 12 седмици на диета с високо съдържание на мазнини, мъжки мишки C57BL/6J бяха рандомизирани в групата CON или CAP. Теглото на тялото при рандомизацията не се различава (Фигура 1а). Анализ на данните за телесното тегло чрез двупосочни повтарящи се мерки ANOVA показва значително взаимодействие между групата и времето (F (12, 324) = 30, 892, P 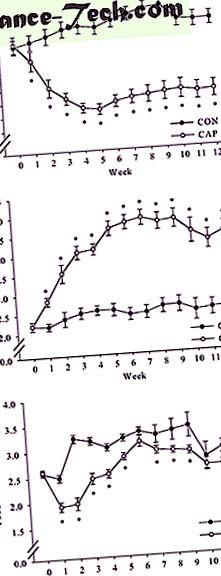
( да се ) Ефект на ОСП върху телесното тегло. Две групи мъжки мишки C57BL/6J (n = 15/група) са били хранени с диета с високо съдържание на мазнини в продължение на 12 седмици и са получавали вода (CON) или CAP за още 12 седмици. Резултатите са изразени като средно ± sem в g (n = 15) (* P * P * P
( да се ) Ефект на ОСП върху GTT. Стойностите се изразяват в mmol l -1 като средно ± sem (n = 15) (* P -1 като средно ± sem (n = 15) (* P -1 спрямо CAP: 21,00 ± 2,21 μg ml -1, t 22df = 5.20373, P -1 спрямо CAP: 14.63 ± 2.37 ng ml -1, t 23df = -5.40193, P
( да се ) Ефект на PAC върху плазмените нива на адипонектин. Резултатите са изразени като средно ± sem в μg ml -1 (n = 15) (* P -1 (n = 15) (* P -1 (n = 15). CAP, каптоприл; FA, мастна киселина; NEFA, Неестерифициран FA.
Изображение в пълен размер
Имаше много висока корелация между плазмената концентрация на лептин и мастната маса на епидидима (Фигура 4а, r = 0.924, Р
( да се ) Корелация между епидидимална мастна и плазмена концентрация на лептин в CON (отворени кръгове) и групи, лекувани с ОСП (затворени кръгове). ( б ) Корелация между епидидималната мастна тъкан и плазмената концентрация на адипонектин в CON (отворени кръгове) и в групи, лекувани с CAP (затворени кръгове). ( ° С ) Корелация между плазмения лептин и плазмената концентрация на адипонектин в CON (отворени кръгове) и третирани с CAP (затворени кръгове) групи. ОСП, каптоприл; С, контрол.
Изображение в пълен размер
MRNA от мастна тъкан
Както е показано на Фигура 5а, експресия на иРНК за лептин (t 25df = -3,28455, P
( да се ) Ефектът на CAP върху лептин, адипонектин, IL-6, MCP-1, UCP2, TLR4, PPARγ, PGC-1α, D9D/SCD1 и HSL в мастната тъкан. Резултатите се нормализират до 28S експресия на рибозомна РНК (* P * P * P 24 Настоящото проучване разширява тези констатации: PAC намалява DIO при мишки и тази загуба на тегло се запазва през целия 12-седмичен период на лечение. В допълнение към тази загуба на тегло, CAP лечението подобрява периферната чувствителност към инсулин, както се посочва от GTT и намалява скоростта на глюконеогенеза в черния дроб, както се посочва от РСТ. -6 и TLR4. В допълнение, в чернодробната тъкан лечението с CAP модифицира експресията на гени, участващи в метаболизма на липидите; експресията на mRNA за PGC-1α, HSL и LCAD се увеличава, докато експресията на mRNA за LPL намалява.
Дванадесет седмици диета с високо съдържание на мазнини води до DIO при мишки C57BL/6J, а последващото лечение с ОСП води до бърза загуба на тегло. В края на втората седмица телесното тегло на мишките, лекувани с ОСП, е с 16% по-малко от това на мишките, които се поддържат само на диета с високо съдържание на мазнини. Тази загуба на тегло се поддържа в продължение на 12 седмици и е 3 до 4 пъти по-голяма от загубата на тегло, регистрирана при плъхове Long-Evans, лекувани с ОСП в доза от 40 mg kg-1 на ден в продължение на 1-2 седмици. 24 Доколкото ни е известно, PAC не е бил ефективен за намаляване на телесното тегло при хората. В клинично изпитване обаче АСЕ инхибиторът еналаприл намалява теглото при пациенти с хипертония. 27
Приемът на течности от лекувани с ОСП мишки е значително увеличен, което е в съответствие с предишни проучвания. 22, 31 Това може да се дължи на повишени нива на брадикинин 44 или повишен синтез на ANG-II в мозъка. 45 Тъй като приемът на течности от лекувани с ОСП мишки е висок в сравнение с този от групата CON, намаляването на приема на храна от мишки, лекувани с ОСП, не се дължи на общо потискане на поведението от ОСП. Освен това, ANG-II не влияе върху приема на храна, предизвикан от грелин 46, въпреки че причинява голямо увеличение на приема на течности. 45 По този начин намаленият прием на храна на лекувани с ОСП мишки не се дължи на увеличен прием на течности.
Преди това беше показано, че PAC подобрява толерантността към глюкозата при различни животински модели. 22, 24 GTT резултати показват, че лечението с ОСП подобрява нарушения глюкозен толеранс при DIO мишки. Това наблюдение предоставя доказателства за инсулинозависимо подобрение на глюкозния клирънс 47 и, което е по-важно, настъпило при животни, които не са имали намалено ниво на NEFA. Подобрен глюкозен толеранс може да възникне в резултат на няколко механизма. Може да се е случило в резултат на намаляване на производството на чернодробна глюкоза поради повишени нива на циркулиране на адипонектин и/или поради повишено усвояване на глюкоза и окисление на FA в скелетните мускули. 48
Чернодробната инсулинова резистентност е основната причина за диабет тип 2. 49,50 При инсулиновата резистентност се увеличава чернодробната глюконеогенеза. 51 За да се определи скоростта на глюконеогенеза в черния дроб, беше извършена РСТ. Резултатите от РСТ показват, че мишките, лекувани с CAP, имат намален процент на чернодробна глюконеогенеза в сравнение с групата CON. Следователно резултатите от GTT показват, че PAC подобрява инсулинозависимия глюкозен клирънс, което показва по-добра периферна чувствителност към инсулин, а резултатите от PCT показват, че PAC специфично инхибира чернодробната глюконеогенеза, което показва по-добра чувствителност към чернодробния инсулин.
IL-6 причинява чернодробна инсулинова резистентност, като инхибира сигнализирането на инсулиновия рецептор и увеличава разграждането на субстрата 1 на инсулиновия рецептор. Доказано е, че 53 TLR4 активира вътреклетъчни възпалителни пътища, включващи NF-κB, който регулира чернодробната инсулинова резистентност, 54 и UCP2, за който е доказано, че е отрицателен регулатор на секрецията на инсулин. 55 Настоящото проучване показва намаляване на експресията на иРНК за гените IL-6, TLR4 и UCP2 в мастните тъкани на мишки, лекувани с CAP, в сравнение с тази на групата CON. Следователно настоящите резултати показват, че ОСП може да подобри инсулиновата чувствителност, но се изисква повече работа за идентифициране на участващите механизми.
В обобщение, CAP намалява DIO при мишки, подобрява глюкозния толеранс и намалява експресията на иРНК за възпалителни маркери. Намаляването на телесното тегло е свързано с намаляване на натрупването на мазнини в мастните и чернодробните тъкани. Повишените нива на адипонектин и намалената експресия на иРНК за UCP2 може да са допринесли за подобрена чувствителност към инсулин. Намаляването на експресията на иРНК за MCP-1, IL-6 и TLR4 може да е довело до намаляване на възпалителния отговор. Следователно, резултатите от настоящото проучване предполагат, че PAC може да бъде обещаващ инструмент за обръщане на DIO, подобряване на чувствителността към инсулин и намаляване на възпалението.
- Типът диета на бебето влияе върху затлъстяването на детето CuidatePlus
- Влияние на диетата върху сърдечно-съдови заболявания, диабет и затлъстяване
- Включването на ябълка в диетата на децата намалява риска от затлъстяване
- Въздействие на затлъстяването и диетата върху псориазис Кожа
- Дигиталното затлъстяване заплашва нашето благосъстояние. Нека променим диетата HuffPost Life
