Дескриптори на DeCS: ХОМОЦИСТЕЙН/метаболизъм; АТЕРОСКЛЕРОЗА.
През последните години доклади, оригинални статии и рецензии за връзката между хиперхомоцистеинемия и атерогенеза се появяват все по-често в световната медицинска литература. Следователно е от интерес да се направи преглед на метаболизма на тази аминокиселина, факторите или обстоятелствата, които могат да причинят или да се развият с повишаване на нейната плазмена концентрация и възможните механизми, които я свързват със сложния феномен на атеросклерозата.
Хомоцистеинът е сярна аминокиселина, метаболитно произхождаща от метионин, незаменима аминокиселина, която освен предшественик и компонент на пептиди и протеини, играе важна метаболитна функция, като участва в система за пренос на метилова група. На фигура 1 е представена последователността от реакции на тази система. След активирането метионинът определя своята метилова група в реакция, катализирана от метилтрансфераза, и води до S-аденозилхомоцистеин, който се демонтира чрез хидролиза на аденозин и се получава свободен хомоцистеин. 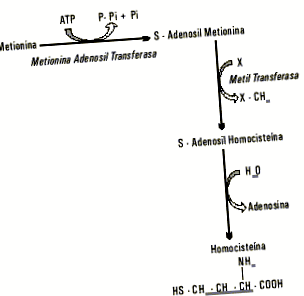
Фиг. 1. Образуване на хомоцистеин от метионин.
Дестинации на хомоцистеин
Други възможни съдби на хомоцистеин
Образуването на дисулфидни мостове може да се случи с други метаболити, които имат тиолова група, това се случва главно с цистеин и се получават смесени дисулфиди на хомоцистеин със свободен цистеин или с цистеинови остатъци от пептиди и протеини. Този последен вариант е известен като свързан с протеини хомоцистеин, 1,2 преобладаващата форма на циркулиращ хомоцистеин. 4 Друга възможност е, че при загуба на водна молекула хомоцистеин тиолактон. две
В много от статиите са разгледани условията плазмен хомоцист (д) ина и хомоцист (д) инемия, Това се разбира като обединение или концентрация в плазмата на свободен хомоцистеин, хомоцистеин, смесени дисулфиди с цистеин, свързан с протеини хомоцистеин и хомоцистеин тиолактон. 2,5,6 Съгласни сме Якобсен 1, тъй като този начин за определяне на многобройните варианти на циркулиращ хомоцистеин е архаичен и неправилен от граматическа и дори практическа гледна точка, следователно правилното нещо би било да се използва терминът общ хомо-цистеин в плазмата или хомоцистеинемия.
Както ще се види по-късно, в повечето клинични проучвания, свързани с този метаболит, се определя плазмената концентрация на общия хомоцистеин, т.е. басейн, от които около 70 до 90% съответства на свързан с протеин, 5 до 10% на хомоцистеин, 5 до 10% на хомоцистеин-цистеин и само около 1% на редуциран хомоцистеин. 1,2 несвързаният протеин се филтрира в бъбречните гломерули, по-голямата част от него се реабсорбира в бъбречните тубули, така че само много малки количества се екскретират с урината. 7
Следователно хомоцистеинът е нормален продукт на метаболизма на метионин, който не циркулира в големи количества, тъй като може да бъде рециклиран по пътя за възстановяване на метионин или пътя на образуване на цистеин. Този метаболит в общото кръвообращение и в тъканите, благодарение на своята тиолова група, има тенденция да образува дисулфидни мостове, както между своите молекули, така и с тези на други съединения от групата -SH. По този начин хомоцистеинът и дисулфидите, които той образува, могат да се разглеждат като редокс двойки: редуцирана форма-хомоцистеин, окислени форми-дисулфиди (хомоцистеин, хомоцистеин-цистеин).
Освен тези описани метаболитни дестинации, интерес представлява специфичен път в ендотелните клетки, включващ азотен оксид. 8 Този интересен химически пратеник реагира със сулфхидрилната група на хомоцистеин в присъствието на кислород и образува S-нитрозо хомо-цистеин, като по този начин блокира възможните реакции на тази група (фиг. 4).
Фиг. 4. Реакция на азотен оксид (NO) в присъствието на кислород
Определяне на плазмен хомоцистеин и референтни стойности
В скорошен доклад на Института по хранене и хранителни технологии в Чили, при 128 предполагаемо здрави възрастни (22 до 78 години), установените плазмени стойности са 9,7 ± 6,0 µmol/L за мъже и 7, 0 ± 3,1 µmol/L за жени. 16.
Хората със стойности на гладно над 15 µmol/L (95-ия процентил) се считат за носители на хиперхомоцистеинемия, 3,6,17 което според Канг а други могат да бъдат класифицирани в умерен (15 до 30 µmol/L), междинен (31 до 100 µmol/L и тежък (> 100 µmol/L). 17 Въпреки това, Якобсен 1 предполага, че може да се говори за "желани стойности", които биха били по-малки от 10 µmol/L.
В случаите на пациенти, при които се подозира възможността за някакво разстройство, свързано с тази аминокиселина и плазменото им ниво на гладно е в рамките на "нормалните" граници тест за претоварване метионин. В този случай, след гладуването през нощта, се измерва базалната плазмена концентрация и след 4 до 8 часа консумация на разтвор на метионин (100 mg на kg телесно тегло). Пациентът се счита за носител на хиперхомоцистеинемия, ако плазмената стойност след претоварване надвишава 2 стандартни отклонения (SDD) от средната стойност на оценките на гладно. 18.
Патогенеза на хиперхомоцистеинемия
Хиперхомоцистеинемии с генетичен произход
Дефицит на N 5, N 10-метилен тетрахидрофолат редуктаза (хомоцистинурия II): Хомозиготни пациенти с дефицит на този ензим по пътя на реметилирането също развиват тежка хиперхомоцистеинемия, с несигурна прогноза, отчасти поради пълното отсъствие на ефективна терапия. 22.23
Вродени грешки на метаболизма на витамин В12: Това са промени в генетичния произход в абсорбцията, транспорта и активирането на кобаламин, които водят до намаляване на активността на метионин синтазата и следователно хиперхомоцистеинемия. 32 Въпреки че също са описани мутации в гена на метионин синтаза, тяхното разпространение и приносът им към повишен плазмен хомоцистеин при хетерозиготни пациенти остава да се изясни. 1
Хиперхомоцистеинемии поради хранителни дефицити
Има многобройни съобщения за повишена плазмена обща концентрация на хомоцистеин при пациенти с хранителен дефицит на кобаламин и фолацин, както и отрицателна корелация между серумните нива на фолат, витамини В12 и В6 и плазмените нива на хомоцистеин. 33-35 Някои автори дори предполагат, че ниските серумни нива на 1 или 3 витамина са фактори, допринасящи за почти две трети от всички случаи на хиперхомоцистеинемия. 3. 4
От друга страна, добавянето с един, главно фолацин, или различни комбинации от тези витамини е било успешно за намаляване на общите плазмени нива на хомоцистеин. 36,37 Ако вземем предвид основните храни, които служат като източници на фолацин и преобладаващите хранителни навици в западните общества, очевидно е, че преобладават парадоксът с ниската консумация на този витамин и преобладаването на храни, относително богати на метионин; с това се благоприятства повишаването на циркулиращия хомоцистеин в постпрандиалния период и следователно възможността за влошаване на ендотелната функция на кръвоносните съдове. 1.38
Други причини за хиперхомоцистеинемия
Хипотиреоидизъм: При пациенти с хипотиреоидна жлеза се съобщава за наличие на хиперхомоцистеинемия без ясно обяснение защо. 1,2 В скорошен доклад 39 авторите установяват по-високи плазмени стойности на хомоцистеин при пациенти с хипотиреоидна жлеза в сравнение с пациенти с хипертиреоидна жлеза и с лица в контролна група. Интересното е, че пациентите с недостатъчно активна щитовидна жлеза също имат по-високи серумни нива на креатинин от контролните.
Злокачествена анемия: Като се вземе предвид ролята на кобаламин в пътя на реметилиране, логично е при пациенти с недостатъчна абсорбция на този витамин да има повишаване на хомоцистеина в плазмата. две
Рак: Високи плазмени нива на хомоцистеин са съобщени при пациенти с различни видове карцином, главно на гърдата, яйчниците и панкреаса; както и в случаите на остра лимфобластна левкемия. Това може да се обясни от експерименталното наблюдение, че клетките, трансформирани в култура, не са способни да метаболизират хомоцистеин. 2.40.41
Наркотици или наркотици: В настоящия терапевтичен арсенал има някои лекарства, които по един или друг начин могат да причинят повишаване на плазмената концентрация на хомоцистеин. Метотрексат, противораково лекарство, има мощно инхибиращо действие върху фолат редуктазата, ключов ензим в активирането на фолацин, поради което консумацията на това лекарство причинява непостоянни увеличения на циркулиращия хомоцистеин. 42 Фенитоин (фенитоин), антиконвулсант с действие на нивото на моторната кора, освен основното му действие, е установена и неговата намеса в метаболизма на фолатите, което обяснява умерената хиперхомоцистеинемия, наблюдавана по време на терапевтичната му употреба. 2,42 Теофилин, от известното семейство метилксантини, чието инхибиторно действие върху фосфодиестеразата е добре известно, може да причини хиперхомоцистеинемия, като пречи на синтеза на пиридоксал фосфат, коензимната форма на витамин В6. Предполага се, че колестипол и никотинова киселина, лекарства, които намаляват нивото на циркулиране на липидите, могат да повишат плазмените нива на хомоцистеин, като променят абсорбцията на фолат. 43
Токсични навици: В изследването на Hordaland в Норвегия е установена връзка между пушенето и прекомерната консумация на кафе и появата на хиперхомоцистеинемия, вероятно поради намеса в синтеза на пиридоксал фосфат. 44,45 Хроничният алкохолизъм също е докладван като причина за повишен плазмен хомоцистеин, което изглежда се дължи на хранителен дефицит при тези пациенти. 46
Пациенти със сърдечна трансплантация: Получателите на сърдечна трансплантация имат умерена до средна хиперхомоцистеинемия, която отчасти може да е свързана с бъбречна недостатъчност. 47
Връзка на хиперхомоцистеинемия с атеросклероза
През почти 3 десетилетия оттогава многобройни проучвания се опитват да изяснят тази възможна връзка, особено чрез разработването на все по-чувствителни и специфични методи за оценка на хомоцистеина. Уелч Y. Лоскалцо 2 се посочва, че повече от 20 проучвания за контрол и надлъжни изследвания са потвърдили тази връзка.
От своя страна Кроненберг, 7 изследовател, изучаващ метаболитни фактори, свързани със сърдечно-съдови усложнения при пациенти с хронично бъбречно заболяване, се позовава на 3 скорошни проспективни проучвания, които показват силна връзка между високите плазмени концентрации на хомоцистеин и атеросклеротичните промени.
Следователно повече от 80 епидемиологични проучвания с рисков подход през последните 10 години 1 потвърждават тази връзка; Това, което остава да се изясни е дали хомоцистеинът или по-скоро хиперхомоцистеинемията е причинен фактор или съпътстващ елемент на атеросклерозата, за да се уточни какви са основните патофизиологични механизми и накрая дали неговата корекция може да служи като превенция или ефективно лечение на неговите сериозни последици, като коронарна болест на сърцето, енцефални съдови инциденти и периферни съдови събития.
Вероятни патофизиологични механизми
Окислителни щети
Преки ефекти на хомоцистеин и хомоцистин
Двуфазен ефект на хомоцистеин също е наблюдаван върху активността на колагеназата, измерена чрез зимография в извънклетъчния матрикс на съдовата стена. 54
Съобщава се и за инхибиране или блокада, упражнявана от редуцираната форма на тази аминокиселина върху взаимодействието на тъканния плазминогенен активатор с анексин II, 55 това може да доведе до промяна в антитромботичния модел на ендотелните клетки на съдовата стена.
В скорошния му преглед Якобсен 1 спекулира с откритието на неговата група: аортните ендотелни клетки от хора в културата не експресират активната форма на цистатионин b-синтаза (CBS), така че тези клетки не могат да инициират хомоцистеинов катаболизъм чрез трансулфурация, което ги прави по-податливи на увеличаване на концентрация.
Същият автор съобщава, че неговата изследователска група е показала, че концентрациите на хомоцистеин от порядъка на 10 до 50 μmol/L стимулират експресията на хемотактичен протеин-1 (PQ-1) в култивирани аортни ендотелни клетки, ефект, който не е наблюдаван. това се постига с други сярни аминокиселини (цистеин, цистин, метионин и хомоцистин). 1 PQ-1 е мощен хемотаксичен агент за моноцити от семейство CC Chemokine, така че този резултат сочи към един от патофизиологичните феномени на атеросклерозата, възпалителния отговор на съдовата стена, в този случай произведен от повишена концентрация на хомоцистеин.
От друга страна, експерименталните резултати на Тяги, 56, които се опитват да покажат, че окислената форма на хомоцистеин, хомоцистеин, може да причини преждевременни атеросклеротични промени в сърцето. Авторът култивира гладки мускулни клетки, изолирани от коронарните артерии на човешките сърца с идиопатична кардиомиопатия. Добавянето на хомоцистин към културите води до очевидно увеличение на броя на ХМЛ, т.е. стимулира се размножаването на тези клетки, което се блокира от добавянето на антиоксиданта N-ацетил цистеин (NAC). Хомоцистинът също индуцира синтез на колаген по начин, зависим от времето и дозата, ефект, който се инхибира чрез добавяне на NAC или редуциран глутатион към хранителната среда. И накрая, той успя да демонстрира способността да свързва хомоцистин чрез протеини от 25 до 40 kDa, открити в плазмената мембрана и цитозола на тези клетки в културата, ефект, който се инхибира от NAC. Авторът предполага, че тези протеини могат да бъдат специфични рецептори за окислен хомоцистеин, като по този начин се разкрива интересна област на изследване.
Ефекти върху метаболизма на азотния оксид (не)
Въпреки това, в гладкомускулните клетки има и друг ефект, Уелч и 58 други съобщават, че хомоцистеинът насърчава, пряко или медииран от реактивни кислородни видове, увеличаването на производството на NO в тези клетки чрез индукция на азотен оксид синтаза 2 (NOS 2), измерено от NFkB, което говори в полза на митогенното действие на хомоцистеин, тъй като ролята на гореспоменатия транскрипционен фактор за пролиферацията на гладкомускулни клетки в културата е доказана. 59
Зависими от хомоцистеин тиолактон разстройства
Няма съмнение, че въпреки огромната връзка на експерименталните открития, все още е рисковано да се твърди, че има безспорна причинно-следствена връзка между хиперхомоцистеинемия и атеросклероза, но е безспорно, че това състояние може да се разглежда като още един рисков фактор за този сложен процес патологичен, присъщ на живота на човека. Познаването на причините и факторите, които благоприятстват повишаването на този метаболит и неговите производни в общото кръвообращение и тъканите, както и възможните начини за коригирането му, главно чрез добавяне на витамини и коректни хранителни навици и, накратко, на здравословен начин на живот - въпреки че не е научно доказано, че намаляването на плазмената концентрация на общия хомоцистеин може да спре атеросклеротичните процеси и техните основни прояви - въвежда нови предизвикателства пред медицинските науки, към подхода на този бич и особено към аспектите на превенцията и промоция на здравето.
РЕЗЮМЕ
Тематични заглавия: ХОМОЦИСТЕЙН/метаболизъм; АТЕРОСКЛЕРОЗА.
БИБЛИОГРАФСКА ЛИТЕРАТУРА
Получено: 1 юни 1999 г. Одобрено: 15 юни 1999 г.
Д-р. Артуро Менендес Ръководител. Ave. Los Ancianos, Сграда No 13, Apt 21. Cast Previsora, Camagüey.
Имейл: [email protected]
Цялото съдържание на това списание, с изключение на случаите, когато е идентифицирано, е под лиценз Creative Commons
