- Субекти
- Обобщение
- Въведение
- Резултати
- Промяна на гликопаттера в серумите поради ASD спрямо TD
- Идентификация на MBG
- Анализ на генната онтология на MBG
- Анализ на KEGG Pathway и Protein Interaction Network
- Предпочитание за мотив на MBG последователност
- Експресия и сиалогикозилиране на MBG в индивидуални серумни проби
- Дискусия
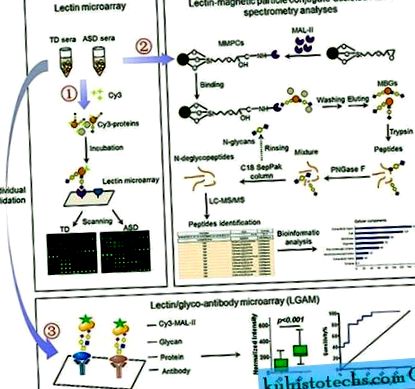
- Материали и методи
- Одобрение на проучването
- Субекти
- Вземане и подготовка на проби
- Лектинови микрочипове и анализ на данни
- Серумен микрочип и анализ на данни
- Изолиране и усвояване на MBG
- LC-MS/MS анализ
- Без етикет относително количествено определяне чрез изчисляване на спектрален индекс
- Извличане на данни и биоинформатика
- Лектин/глико-антитела микрочипове и анализ на данни
- Допълнителна информация
- Допълнителна информация
- PDF файлове
- Допълнителна информация
- Excel файлове
- Допълнителни таблици
- Коментари
Субекти
- Нарушения на аутистичния спектър
- Биомаркери
- Glucomics
Обобщение
Инструментите за протеомика позволяват широкомащабен автоматизиран режим на изследване, управляван от технологията, който предоставя възможност за определяне на целия протеом в дадена телесна течност без предварителни предположения за кандидат-молекули 12. Въз основа на това се установи, че общо пет пептидни компонента, съответстващи на четири известни протеина [Apolipoprotein (apo) B-100, Complement factor H-related protein (FHR1), Complement C1q и Fibronectin 1 (FN1)] са по-високи за аутизъм в сравнение с контролите 13. Три потенциални пика на биомаркери показаха m/z съотношения от приблизително 4,40, 5,15 и 10,38 kDa значително диференцираха пробата ASD от контролната група при анализ на цели протеини и непептиди след триптично разграждане 14 .
Изображение в пълен размер
Резултати
Промяна на гликопаттера в серумите поради ASD спрямо TD
Дизайнът на лектиновия микрочип и произтичащите от него гликопатерни на серумните гликопротеини, дефинирани от микрочиповете за групите ASD и TD, са показани на фиг. 2А, Б. Оригиналните данни са импортирани в EXPANDER 6.0 за анализ на йерархичен клъстер (фиг. 2 В) . Нормализираните флуоресцентни интензитети (NFI) и специфичността на свързване на захар за всеки от 37-те лектина от двете групи са обобщени в таблица S1. В резултат на диференциалния анализ пет лектина показват значителни разлики между групите ASD и TD. MAL-II (Siaα2-3 Gal/GalNAc) и MAL-I (Siaα2-3Galβ-1, 4GlcNAc и Galβ-1, 4GlcNAc) показват най-значително увеличени NFI (промяна в пъти = 3,33 и 2,20, p
( ДА СЕ ) Дизайн на лектиновия микрочип. ( Б. ) Изображения на TD и ASD Cy3-белязани серумни протеини, свързани с лектинови микрочипове. Флуоресцентните изображения бяха сканирани със 70% фотоумножителна тръба и 100% настройки на мощността на лазера на конфокален скенер Genepix 40 00B. Част от предметното стъкло е показана с три репликирани лектинови масива. Лектините показаха значителни разлики, маркирани с бели рамки. ( ° С ) NFI йерархичен клъстер анализ за 37 TD-1 лектини
5. Пробите са изброени в колони, а лектините - в редове. Цветът и интензивността на всеки квадрат показват нива на изразяване спрямо останалите данни в реда. Червено, високо; погледнете по-долу; черен, среден. Жълтата и синя рамка отбелязват по-висока и по-ниска интензивност на свързване на лектин при ASD спрямо TD серуми. ( д ) Диференциален анализ на NFI за пет TD-1 лектини
( А, Б ) Идентифициране на пептиди и съответстващите им гликопротеини в TD и ASD серуми чрез LC-MS/MS. ( ° С ) Пропорция на N-гликопротеини (NY) и O-гликопротеини (OY), известни от базата данни UniProtKB/Swiss-Prot и прогнозираните гликопротеини с потенциални места на N-гликозилиране (NP) и потенциални сайтове на O-гликозилиране (OP)) д ) Анализ на пътя на KEGG на идентифицирания GBM (маркиран с червена звезда) в комплементарната и коагулационната каскада 60. Червена стрелка, регулиране нагоре на MBG; зелена стрелка, ниско регулиране на GBM в ASD. Анализ на мрежата за протеиново взаимодействие на идентифицирани GBM (червена сфера), които са регулирани нагоре (червена стрелка) или надолу (синя стрелка) при регулиране ( И ) и отрицателна регулация ( F ) на процесите на стимулна реакция в ASD серуми. ( G ) Възможни мотиви за N-гликозилиране и O-гликозилиране около остатъците от аспарагин и серин за α2-3-свързания сиалилиран гликопептиден домен. WebLogo генерира относителни честотни графики на мотива на значимата последователност. Височините на остатъците са приблизително пропорционални на техните биномни вероятности.
Изображение в пълен размер
Анализ на генната онтология на MBG
Анализ на KEGG Pathway и Protein Interaction Network
Общо 184 от 243 идентифицирани MBG са коментирани в DAVID Bioinformatics Resources (версия 6.7). Тези MBG са картографирани в 6 KEGG пътища с прагове на броене ≥5 и стойност P 30 (допълнителна фигура S1). Честотата на аминокиселините, специфични за позицията, на околните остатъци от аспарагин (13 аминокиселини и в двата термина) бяха сравнени и мотивът [AVH] [KR] xNxxNxSxxxY (където "x" означава всеки остатък, [AVH] и [KR] представлява Бяха идентифицирани няколко аминокиселинни остатъка, които биха могли да се появят в позицията и винетката показва възможен гликозит) като възможен мотив за N-гликозилиране около аспарагина (фиг. 3G). Интересното е, че мотивите xxxxxxQSDxxYK и xxxxxxHGSxSGx бяха значително свръхпредставени (увеличение на пъти = 81,62 и 67,07) в данните на GBM (фиг. 3G), което може да представлява мотиви на O-свързано гликозилиране около серинови остатъци за глиапептидния домен, сиалилиран, прикрепен към α2. За да потвърдите допълнително O-глюкозитите в MBG, все още се нуждаете от много по-подробни проучвания.
Експресия и сиалогикозилиране на MBG в индивидуални серумни проби
Уестърн блотинг се извършва, за да се провери експресията на C8B, серотрансферин (TF), C1QA и APOD в отделни серумни проби. В резултат на това експресията на C8B и TF се увеличава и експресията на C1Q намалява в четири тествани ASD проби в сравнение с четири TD проби, които съответстват на резултатите от MS (фиг. 4А). Експресията на APOD обаче не се различава значително между пробите TD и ASD (фиг. 4А). LGAMs са проектирани да открият α2-3-свързано сиалогликозилиране на C8B, TF, C1QA и APOD в 15 отделни TD и 15 ASD серумни проби (Фиг. 4B). В резултат на това не са открити значителни разлики за C8B, TF и C1QA сиалогикозилиране между две групи. Въпреки това, APOD α2-3 сиолокозилирането беше значително увеличено в проби ASD спрямо TD проби (p = 0.004) (Фиг. 4C). Анализът на ROC кривата разкрива, че серумните нива на α2-3 сиалогикозилиран APOD водят до AUC от 0,88, със специфичност от 86,7% и чувствителност от 80,6% за диференциране на ASD от TD) (фиг. 4D).
( ДА СЕ ) Western blot анализ на експресия на C8B, TF, C1QA и APOD в четири TD и четири ASD серумни проби. ( Б. ) Сканирайте изображения, получени от LGAMs за TD и ASD серуми. ( ° С ) Анализ на графиката на интензитета на свързване за C8B, TF, C1QA и APOD на 30 серумни случая на TD и ASD от LGAMs. Лентите за грешки представляват 95% доверителни интервали за средствата. Статистически значимите разлики между групите се посочват от стойностите на Р ( д ) Анализ на ROC крива на α2-3 сиалогикозилиран APOD за разграничаване на ASD проби от TD проби.
Изображение в пълен размер
Дискусия
Обикновено сиаловата киселина се намира като компонент на олигозахаридните вериги на муцини, гликопротеини и гликолипиди, които заемат нередуциращи крайни позиции на N- или O-гликани. Нивата на сеалова киселина в серума са свързани с чернодробни заболявания 46, ревматични заболявания 47 и диабет тип 2 48. В това проучване анализът Western blot потвърждава промяната на експресията на C8B, TF и C1QA, но не и APOD експресията в отделни серумни проби ASD и TD (фиг. 4А). LGAMs разкриват значително повишена експресия на APOD α2-3 сиалогикозилиране в отделни ASD серумни проби, което до голяма степен обяснява разликата в APOD експресията на протеин между ASD и TD серуми и подчертава, че както MBG, така и тяхното α2-3 сиалогикозилиране са свързани с ASD. Анализът на ROC кривата показа, че сиалогикозилираният APOD може чувствително и специфично да разграничи децата с ASD от децата с TD като биомаркери-кандидати (AUC = 0,88) и посочи значението и необходимостта от изследване на промяната в гликозилирането на гликопротеините в серумите за диагнозата на ASD.
В заключение, експресията на сиалозил-Т а2-3 антигени беше значително увеличена при ASD спрямо TD серуми. Общо 194 и 217 MBG са идентифицирани съответно от TD и ASD серуми, от които 74 протеини са специално идентифицирани или регулирани в ASD серуми. Биоинформатичният анализ разкрива, че анормалната каскада на комплемента и анормалната клетъчна регулация на отговора на стимула могат да бъдат нови създатели или маркери на ASD, предоставяйки нова информация за бъдещи задълбочени изследвания на патогенезата на ASD. По-важното е, че LGAMs разкриват значително по-висока експресия на APOD α2-3 сиалогикозилиране в отделни серумни проби от ASD, което може да служи като потенциални биомаркери за диагностика на ASD.
Материали и методи
Одобрение на проучването
Събирането и използването на всички проби от човешка патология за представените тук изследвания бяха одобрени от Комитета по етика на Северозападния университет, провинциалната болница Шанси и Четвъртия военномедицински университет (Сиан, Китай). Участниците получиха писмено информирано съгласие за събирането на цялата им слюнка и серум. Това проучване е проведено в съответствие с етичните насоки на Декларацията от Хелзинки.
Субекти
Таблица в пълен размер
Одобрението за това изследване беше получено от Комитета по етика и Комитета за преглед на изследванията на човека от университета Сиан Джиаотонг (Сиан, Китай). Всички родители на участниците, записани в проучването, са дали своето писмено информирано съгласие. Всички експерименти бяха проведени в съответствие с одобрените насоки.
Вземане и подготовка на проби
Всички кръвни проби бяха събрани от педиатрична медицинска сестра и бе събрана венозна кръв. Кръвта се оставя да се съсирва при стайна температура в продължение на 25 минути. След това съсирекът се отстранява чрез центрофугиране при 1500 g за 10 минути в хладилна центрофуга. Полученият супернатант незабавно се прехвърля в чиста полипропиленова епруветка, добавена с коктейл без инхибитор на EDTA (инхибитор на Halt протеаза; Thermo Scientific Pierce Protein Research Products, Rockford, IL, USA) при серумна концентрация 10 μL./Ml. Полученият серум се аликвотира на малки порции и веднага се замразява върху сух лед и се съхранява при -80 ° C. За да се нормализират разликите между субектите и да се толерират индивидуални вариации, 50 μL от 50 серумни проби бяха събрани съответно от TD и ASD групите за лектинови микрочипове и LC-MS/MS откриване. Останалите 15 проби от всяка група бяха индивидуално поддържани за по-късно валидиране.
Лектинови микрочипове и анализ на данни
Лектиновият микрочип е произведен и инкубиран с Cy3 флуоресцентни маркирани с оцветител серумни протеини (GE Healthcare) съгласно нашия предишен протокол 50, 51, 52, 53, който е подробно описан в допълнителните материали и методи. 50 TD и 50 ASD серумни проби бяха използвани за откриване на лектинов микрочип. Двадесет микролитра (20 μL) от всяка проба и 10 проби в басейн бяха приготвени, за да образуват подгрупите TD-1.
5. Придобитите изображения бяха анализирани при 532 nm за откриване на Cy3, използвайки софтуера Genepix 3.0. Средният фон се изважда и стойности по-малки от средния фон ± 2 стандартни отклонения (SD) бяха премахнати от всяка точка от данните. Медианата на ефективната точка от данни за всеки лектин е нормализирана в световен мащаб до сумата от медианата на всички ефективни точки от данни за всеки лектин в блок. Всяка проба се наблюдава последователно с три повторни слайда и нормализираната медиана на всеки лектин от 9 повторни блока се осреднява и SD се определя. Нормализираните данни за TD и ASD групите бяха сравнени съгласно следните критерии: промяна на сгъване ≥1.5 или ≤0.67 показваше регулиране нагоре или надолу. Разликите между двата произволни набора от данни бяха тествани чрез t-тест на сдвоен студент, използвайки SPSS статистика 19. Оригиналните данни бяха допълнително анализирани с Expander 6.0 (//acgt.cs.tau.ac.il/expander/), за да се извърши йерархично клъстериране анализ.
Серумен микрочип и анализ на данни
Получен е серумен микрочип, като се използват 30 отделни серумни проби от 15 деца от TD и 15 ASD. Маркираният с Cy3 MAL-II се прилага за откриване на специфичната захарна структура в минималното количество серумни проби, които се имобилизират върху предметните стъкла, съгласно производствения протокол на слюнчената микрочип 51 с някои модификации. Подробна информация е предоставена в допълнителните материали и методи.
Изолиране и усвояване на MBG
Конюгатите с магнитни частици MAL-II (MMPC) се приготвят, както е описано 54, 55. Два милиграма (
30 μL, измерено с реагент на Брадфорд) протеин от обединени TD и ASD серуми бяха инкубирани с MMPCs 54, 55. Получените гликопротеини (около 150 μg) се усвояват от трипсин и PNGase F, както е описано по-рано 54, 55, 56. Подробна информация е предоставена в допълнителните материали и методи.
LC-MS/MS анализ
MS анализът се извършва с помощта на LTQ Orbitrap XL масспектрометър (Thermo Scientific). Подробните параметри, използвани в този експеримент, са предоставени в допълнителните материали и методи. Необработените данни бяха обработени с помощта на Proteome Discoverer (версия 1.4.0.288, Thermo Fischer Scientific). MS/MS спектрите бяха търсени с SEQUEST engine срещу цялостната база данни за протеоми на UniProt и база данни за замърсители (Release 2013_06, 88913 Протеинови последователности). Търсенето е извършено със следните параметри: толеранс на масата на прекурсора 20 ppm; MS/MS толеранс на масата 0.6 Da; две пропуснати разцепвания за триптични пептиди; променливи модификации окисление (M), метилтио (C), пептидни спектрални съвпадения (PSM) са валидирани чрез целево търсене в база данни за примамки (FDR ≤ 0,01).
Без етикет относително количествено определяне чрез изчисляване на спектрален индекс
След идентифициране на пептид, алгоритъм, подобен на ProteinExtractor в ProteinScape, който използва даден минимален пептиден резултат (minPepScore) и минимален брой пептиди на протеин (minNrPeps), беше приложен, както е описано 57. Сред изброените протеини се извлича всяко съвпадение на пептидния спектър (PSM). Спектралният индекс (SI) въз основа на спектрален и пептиден брой се изчислява, както е описано по-рано 58. Суровият спектрален брой за идентифицирани протеини се нормализира, като се използват следните формули (Формула 1 и Формула 2):
където C i е общият спектрален брой на изпълнение i; y е усредненият общ спектрален брой на всички подлежащи на сравнение; N i и Ri са съответно нормализираният и суров спектрален брой на протеин в цикъл i. SI,/C i, беше използван за нормализиране на общия спектрален брой на всеки цикъл, за да се намали вариабилността между циклите.
Извличане на данни и биоинформатика
Анализът на данни и професионалните софтуери, използвани в това проучване, са подробно описани в допълнителните материали и методи.
Лектин/глико-антитела микрочипове и анализ на данни
Допълнителна информация
Как да цитирам тази статия: Qin, Y. et al. Серумен гликопаттерн и Maackia amurensis лектин-II свързващи гликопротеини при разстройство от аутистичния спектър. Sci. Rep. 7, 46041; doi: 10.1038/srep46041 (2017).
Бележка на редактора: Springer Nature остава неутрален по отношение на юрисдикционни претенции за публикувани карти и институционални принадлежности.