Нарича се още натриев киселинен карбонат, мононатриев карбонат, сол на Виши или натриев бикарбонат. Този продукт, NaHCO 3, се характеризира като бял кристален прах, без мирис, със солен вкус и леко алкален. Разтворим във вода и практически неразтворим в алкохол. Той е непроменим на сух въздух, но се разлага във влажен.
Разтваря се в 9 части студена вода. Ако този разтвор се разбърка, част от бикарбоната се губи поради отделянето на CO 2 и същото се случва, ако се нагрява над 70 ° C. Нагрята до 400 ° C тази сол се трансформира в неутрален карбонат, с приблизителна загуба от 35% от примитивното си тегло.
Безводният натриев карбонат, известен като сода Solvay, сода за пране, сода или калцинирана сода, се използва в промишлени количества за производството на стъкло, сапуни, хартия, емайли и други химически продукти, както и за пречистване на твърда вода.
Натриевият бикарбонат се използва като стомашен антиацид в медицината. По-голямата част от бикарбоната, произведен на индустриално ниво, се използва за превръщането му в натриев карбонат чрез леко нагряване, според реакцията:
2 NaHCO 3 (s) Na 2 CO 3 (s) + H 2 O (g) + CO 2 (g)
От биологична гледна точка CO 2 и HCO 3 - са отговорни за киселинния и основния резерв в живите организми.
стъклена фуния kitasato колба
утаяваща ампула 15 ml и 100 ml епруветки
измийте бутилка 3 епруветки erlenmeyer колба buchner фуния
100 мл бехерова чаша 1 бюрета
NaCl AgNO 3 0.5M
CaCO 3 фенолфталеин (FT)
NH 3 15M (търговски) 0,1 N HCl основен разтвор
100 ml 6M HCl (Приготвен от студентите) Метилоранж (NM)
Синтезът на NaHCO3 на индустриално ниво се извършва по метода на Solvay, базиран на реакцията, която протича между наситен разтвор на натриев хлорид във воден амоняк и въглероден диоксид, от който може да се отдели твърдият натриев бикарбонат.
Суровините са обикновена сол (NaCl), варовик (съставен главно от CaCO 3), както евтини материали, така и амоняк, които по-късно могат да бъдат извлечени от разтвора на амониев хлорид. Въз основа на процеса на Solvay, ние ще извършим синтеза на бикарбонат със следната реакционна система:
В първата част на системата ще произвеждаме CO 2, за това бавно добавяме HCl към CaCO 3 .
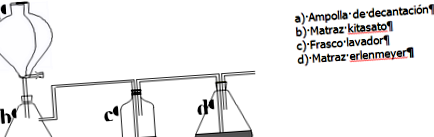
В бутилката c измиваме CO 2, освободен, за да елиминираме примесите. Когато достигне колбата d, той реагира с наситения разтвор на обикновена сол във воден амоняк, който се образува главно от йони: NH 4 +, OH -, Cl - и Na + .
CO 2 реагира с вода и амоняк, образувайки NH 4 HCO 3, който се дисоциира, давайки монохидрогенен карбонат, който накрая в наситен разтвор на NaCl се утаява като натриев бикарбонат
Поради насищането на CO 2 и времето, което трябва да остане за най-добра кристализация на бикарбоната, той не се получава чист, а се смесва с натриев карбонат. Поради тази причина процентът на всяка сол в получения продукт ще бъде оценен и определен.
МЕТОД ЗА СИНТЕЗ
Първо се сглобява реакционната система. Приготвят се 100 ml 6М НС1; Претеглят се 8 g NaCl и 40 g CaCO3 .
В витрина търговският NaCl се поставя в мензура и се добавят 20 ml търговски амоняк. Когато на практика всичко се разтвори, разтворът се филтрира през колба на Ерленмайер чрез нагънат филтър.
6М HCl се поставя в отделящия флакон (а). В колбата за китасат (b) поставете CaCO 3. Водата се поставя в бутилката за междинно измиване (стъклената тръба трябва да е под повърхността на течността). (г) е колбата на Ерленмайер с наситения разтвор на NaCl във воден амоняк.
След като реакционната система е сглобена, ние бавно добавяме 6М НС1 върху СаСО3 и еволюиралият СО2 се барботира върху разтвора d в продължение на 30 минути. Оставя се да кристализира за една нощ и получената утайка се филтрира през фуния на Бюхнер; измива се с 20 ml 50% етанол, суши се на въздух.
1. Установете реакциите, които протичат в различните области на системата за събиране.
В зона c на реакционната система проверете стойността на pH преди и след преминаването на CO 2 .
2. Опишете външния вид на получения продукт
1. Разтворете част от продукта в 5 ml вода. Измерете pH на получения разтвор. Обосновете споменатото pH с помощта на подходящото йонно уравнение.
2. Поставете втора порция от получения продукт в епруветка и я загрейте. Посочете реакцията, която протича. Охладете епруветката и добавете 5 ml вода. Измерете рН и го сравнете с това, получено в 1. Напишете йонното уравнение, което оправдава рН на този разтвор.
3. Поставете трета порция от продукта в епруветка и добавете 2 ml 3M HCI.Какъв газ се отделя? Напишете съответното химично уравнение.
4. Ако AgNO 3 се добави към водния разтвор на бикарбонат, се получава бяла утайка. Което може да се дължи?
ОПРЕДЕЛЯНЕ НА ПРОЦЕНТА НА NaHCO 3 и Na 2 CO 3