Вижте статиите и съдържанието, публикувани в този носител, както и електронните резюмета на научни списания към момента на публикуване
Бъдете информирани по всяко време благодарение на сигнали и новини
Достъп до ексклузивни промоции за абонаменти, стартиране и акредитирани курсове
Следвай ни в:
- Въведение
- Материали и методи
- Резултати
- Дискусия
- Въведение
- Материали и методи
- Приготвяне на ebhg със или без bfgf
- Експериментални животни
- Индукция на експериментален ааа
- Групи за лечение
- Хистологичен анализ
- Статистически анализ
- Резултати
- Промени в деня в 5-те групи
- Хистологичен анализ
- Дискусия
- Библиография
Аневризма на коремната аорта (AAA) е често срещано и животозастрашаващо разстройство, характеризиращо се с дисбаланс между разрушаване и синтез на извънклетъчния матрикс на аортната стена. Образуването на аневризма е свързано с хронично трансмурално възпаление, изчерпване на популацията на гладките мускулни клетки (SMC) и прекомерно производство на металопротеиназна матрица (MMP), което причинява необичайно разграждане на еластин и колаген 1, две. Стандартното лечение на ААА е хирургична корекция чрез поставяне на съдови импланти, както и ендоваскуларно възстановяване на аневризмата, всички с цел предотвратяване на леталното разкъсване на ААА. Все още обаче няма ефективно медицинско лечение за стабилизиране на аневризмалната патология и предотвратяване на по-нататъшно разширяване или разкъсване.
В описаното тук изследване ние лекувахме плъхове с експериментална AAA, като използвахме гъба с желатинов хидрогел (EBHG) или EBHG с включен bFGF, за да изследваме ефектите от тези лечения върху развитието на експерименталната AAA.
Материали и методи Приготвяне на EBHG със или без bFGF
Рекомбинантен човешки bFGF с изоелектрична точка 9,6 се доставя от Kaken Pharmaceutical (Токио, Япония). EBHG се приготвя, както е описано по-рано 13. EBHG се получава чрез омрежване на киселинен желатин с изоелектрична точка 4.9. Той беше хвърлен в лист (15 х 7 х 2 мм) и лиофилизиран. Преди да се постави EBHG върху аортата, лиофилизираният EBHG се накисва с воден разтвор със или без bFGF за 1 h, за да се получи EBHG съответно със или без bFGF. Този лист от желатинова гъба е проектиран да се разгражда за 2 седмици.
Експериментални животни
Мъжки плъхове Sprague-Dawley (250-400 g) са получени от CLEA (Токио, Япония) и са използвани за експериментите. Това проучване е разрешено от Комитета за грижа за животните към Медицинския факултет на университета Тохоку. Грижите за животните са били в съответствие с разпоредбите на Ръководството за грижа и използване на лабораторни животни (Национален съвет за изследвания, Вашингтон, DC, 1996).
Индукция на експериментална AAA
Плъховете се анестезират с i.p. инжекция. на натриев пентобарбитал (50-60 mg/kg телесно тегло: Dainippon Pharmaceutical, Осака, Япония), и лапаротомия по средна линия се извършва при стерилни условия. Изолиран е 1 см сегмент на инфрареналната аорта и всички лумбални артерии са лигирани. Външният диаметър на аортата беше измерен преди инфузия на еластаза (DA инфузия) с помощта на дигитален шублер (Mitutoyo, Kanagawa, Япония). Полиетиленов катетър (Becton Dickinson, Sparks, MD) беше вкаран в дясната външна илиачна артерия и придвижен към изолираната аорта. В проксималната аорта е поставена атравматична скоба и е направено временно лигиране над дисталната аорта, за да се фиксира сондата. Изолираната аорта се влива с 2,7 единици свинска панкреатична еластаза тип I (E-1250, партида 84K7700; Sigma, Сейнт Луис, Мисури) в продължение на 60 минути с помощта на инжекционна помпа (TOP-5200; TOP, Токио, Япония). След вливане на еластазата, лигирането и сондата бяха отстранени, лигирайки дясната външна илиачна артерия. Ретроперитонеумът и коремната стена бяха затворени. Плъховете бяха преразгледани на 14-ия ден след интервенцията (14 DPI) и беше измерен максималният DA.
Групи за лечение
Експерименталните плъхове с инфузия на еластаза бяха разделени на случаен принцип в 5 групи според леченията: група без лечение (нетретирана група, n = 10), група, третирана с EBHG с включена дестилирана вода (група EBHG, n = 10), 3 групи с EBHG с различни включени количества bFGF (група EBHG + 100 ng, група EBHG + 1 μg и група EBHG + 10 μg; n = 10, 6 и 6, съответно). Тези EBHGs бяха поставени върху аортите на плъхове, напоени с еластаза, и ретроперитонеумът беше затворен.
Проведена е хистологична оценка на 3 групи плъхове, включително нелекуваната група, групата само с EBHG и групата с EBHG '100 ng (n = 6, съответно). Плъховете бяха умъртвени на 14-ия ден след интервенцията; 4% разтвор на параформалдехид във фосфатно буфериран физиологичен разтвор (PBS) се перфузира в продължение на 5 минути през лявата камера и отстранените аорти се фиксират отново с 4% разтвор на параформалдехид в PBS за 2 часа, последван от 100% етанол. Образците бяха вградени в парафин и бяха получени 5 μm хистологични срезове, които бяха оцветени с петно Verhoeff-van Gieson (VVG) за еластични влакна и подготвени за тяхното имунохистохимично изследване. Съотношението на оцветените еластични влакна/площ на средната стойност при VVG оцветяване беше изчислено с помощта на софтуера Image-J (NIH, Bethesda, MD).
Имунохистохимичното проучване е проведено след депарафинизация и рехидратация. Секциите бяха третирани в продължение на 10 минути с H202, за да се блокира ендогенната пероксидазна активност. След блокиране с 1% говежди серумен албумин в PBS в продължение на 30 минути, хистологичните срези бяха инкубирани с първично антитяло за една нощ при 4 ° C, включително миши моноклонално антитяло срещу α-гладкомускулен актин (α -SMA) човек (Sigma) за оцветяване на CML на плъх и заешко антитяло към bFGF на плъх (Santa Cruz Biotechnology, Santa Cruz, CA). Впоследствие се извършва инкубация с биотинилирано вторично антитяло и авидин-биотинов комплекс (Dako Cytomation, Glostrup, Дания) съгласно протокола на производителя. Хистологичните разрези бяха оцветени с хематоксилин. Проведени са експерименти с отрицателен контрол чрез заместване на първичното антитяло с неспецифичен миши или заешки имуноглобулин G. Медиалната CML плътност се определя чрез усредняване на α-SMA положителни клетки в 8 полета с висока мощност, избрани от 2 хистологични секции.
Данните са представени като средна стойност ± стандартна грешка (SE). Резултатите се оценяват с помощта на еднопосочен или двупосочен дисперсионен анализ (ANOVA) със статистическа значимост, присвоена на postffe hoc p на Scheffe за сравняване на отделни групи. Статистическият анализ беше извършен с помощта на софтуера StatView J-5.0 (SAS Institute, Cary, NC).
Резултати LAD промени в 5-те групи
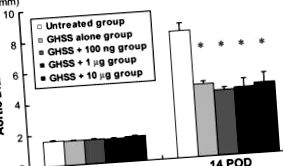
Измененията на DA в 5-те групи плъхове с експериментална AAA, индуцирана от инфузия на еластаза, са представени на Фигура 1. DA-инфузиите преди инфузията са били доста сходни между 5-те групи. Инфузията на еластаза в продължение на 60 минути значително увеличава DA при 14 DPI в нетретираната група от 1,66 ± 0,02 до 8,16 ± 0,50 mm. При същите условия, всички лекувани групи (само EBHG, EBHG + 100 ng, EBHG + 1 μg и EBHG + 10 μg) са показали значително по-нисък DA при 14 DPI (4.66 ± 0.20, 4, 19 ± 0.15, 4.30 ± 0.54 и съответно 4,52 ± 0,64 mm) от тази на нетретираната група. Не са наблюдавани значителни разлики в DA между групата, приемаща самостоятелно GABB, и 3-те групи, лекувани с GABB плюс bFGF.
AD промени във всяка група. Предварителна инфузия, преди инфузия на еластаза. Данните са представени като средна стойност ± SE n = 10 в нетретираните, EBHG и EBHG + 100 ng групи; n = 6 в групите EBHG + 1 μg и EBHG + 10 μg. * p Хистологичен анализ
Изследвахме наличието на α-SMA в еластични влакна и ХМЛ в средния слой чрез VVG оцветяване и имунооцветяване, съответно. Оцветяването с VVG разкрива значително намаляване на оцветените еластични влакна в средната стойност на нетретираната група (фиг. 2а и 2б). За разлика от това, оцветяването на еластичните влакна е добре запазено в групите EBHG и EBHG + 100 ng (Фигури 2в до 2е). Съотношението между площта на оцветените еластични влакна и площта на средната стойност, изчислено с помощта на цифрово компютърно изображение, е значително по-високо в EBHG (23,8 ± 2,6%) и EBHG + 100 ng (24,8 ± 2,2%) отколкото в нелекуваната група (16,8 ± 0,9%), въпреки че не се наблюдават значителни разлики в съотношението между групата на EBHG и EBHG + 100 ng (фиг. 3). Броят на CML, оцветени от α-SMA антитяло в средната стойност, е значително по-висок в групите EBHG (81,8 ± 3,6/hpf) и EBHG + 100 ng (86,1 ± 2,2/hpf), отколкото в групата на нелекувани (67,6 ± 3,2/hpf ), въпреки че няма значителни разлики в броя на ХМЛ между групите EBHG и EBHG + 100 ng (Фиг. 4 и 5).
Микрофотографии на аортната стена с VVG оцветяване за еластични влакна. Еластичните влакна са боядисани в черно. Необработени групи (a, b), само EBHG (c, d) и EBHG + 100 ng (e, f). AD: адвентиция; GHSS + 100 ng: биоразградима гъба с желатинов хидрогел (EBHG) + 10 ng; Само GHSS: само EBHG; М: средно; Нелекувано: не лекувано. Оригинално увеличение x100 (изображения отляво) и x400 (изображения отдясно).
Съотношението на еластичните влакна/площ на средната стойност при VVG оцветяване беше изчислено с помощта на софтуера NIH Image-J. Резултатите са представени като средно ± SE във всяка група. n = 6 във всички групи. * p (a), EBHG самостоятелно (b) и EBHG + 100 ng (c). AD: адвентиция; GHSS + 100 ng: биоразградима гъба с желатинов хидрогел (EBHG) + 100 ng; Само GHSS: само EBHG; М: средно; Нелекувано: не лекувано. Оригинално увеличение x400.
Фотомикрографии на аортната стена с имунооцветяване на ХМЛ с анти-α-SMA. ЦМЛ цитоплазмата в средата е оцветена в кафяво. Необработени групи (a), EBHG самостоятелно (b) и EBHG + 100 ng (c). AD: адвентиция; GHSS + 100 ng: биоразградима гъба с желатинов хидрогел (EBHG) + 100 ng; Само GHSS: само EBHG; М: средно; Нелекувано: не лекувано. Оригинално увеличение x400.
Плътността на медиалния ХМЛ се определя според броя на клетките, положителни за α-SMA в 8 полета с висока мощност, избрани в две хистологични секции. Резултатите са представени като средна стойност ± SE. N = 6 във всяка група. * p (a), само EBHG (b) и EBHG + 100 ng (c). AD: адвентиция; GHSS + 100 ng: биоразградима гъба група с желатин хидрогел (EBHG) + 100 ng; Само GHSS: само EBHG; М: средно; Нелекувано: не лекувано. Тези резултати разкриват увеличение на bFGF-положителни клетки (цитоплазма и ядро) в средата и адвентицията само на EBHG и EBHG + 100 ng групи в сравнение с нетретираната група. Оригинално увеличение x200.
Микрофотографии на аортната стена, имунооцветени с анти-bFGF антитяло. Необработени групи (a), само EBHG (b) и EBHG + 100 ng (c). AD: адвентиция; GHSS + 100 ng: биоразградима гъба група с желатин хидрогел (EBHG) + 100 ng; Само GHSS: само EBHG; М: средно; Нелекувано: не лекувано. Тези резултати разкриват увеличение на bFGF-положителни клетки (цитоплазма и ядро) в средата и адвентицията само на EBHG и EBHG + 100 ng групи в сравнение с нетретираната група. Оригинално увеличение x200.
Това проучване първоначално е предназначено да изследва терапевтичните ефекти на EBHG с включен bFGF върху прогресията на експерименталния AAA, използвайки миши модел AAA. EBHG се използва за поддържане на местните и дългосрочни ефекти на bFGF. Приготвихме две групи плъхове с AAA, които действаха като контроли, включително група без никакво лечение и друга, третирана с EBHG без включен bFGF, тъй като ефектът на EBHG върху експерименталния AAA не беше ясен. Въпреки че DA при 14 DPI на плъховете EBHG 'bFGF е значително по-нисък от този на нетретираните плъхове, само EBHG плъховете имат почти същия DA при 14 DPI в сравнение с плъховете EBHG + bFGF. Нашите резултати също демонстрираха независим от дозата ефект на bFGF. Тези резултати предполагат, че поставянето на EBHG върху аортата има значителни терапевтични ефекти върху прогресията на AAA, докато допълнителният терапевтичен ефект на bFGF е доста ограничен.
Индукцията на експериментална AAA чрез инфузия на еластаза първоначално се извършва от Anidjar et al, 17, които съобщават, че патологичните резултати от този модел са подобни на тези при човешки AAA. В това проучване ние оценихме еластичните влакна и средните CML, които са драстично намалени при човешки AAA и експериментални AAA 1,17. Нашите резултати демонстрираха значително намаляване на еластичните влакна и ХМЛ при нетретирани плъхове, както е описано в предишни проучвания, докато плъховете, третирани само с EBHG, значително намаляват това намаляване на еластичните влакна и ХМЛ. Лечението с EBHG + bFGF също намалява това намаление, но не се наблюдава статистическа разлика между плъховете EBHG и плъховете EBHG + bFGF. Тези резултати предполагат, че EBHG сам по себе си прави подобрение в аневризматичната стена чрез запазване на еластичните влакна и ХМЛ, като по този начин води до по-ниска AD.
Добавянето на bFGF имаше малък терапевтичен ефект в това проучване. Освен това не се наблюдава дозозависим ефект на bFGF върху прогресията на експерименталния AAA. Въпреки че е известно, че bFGF улеснява пролиферацията на различни мезенхимни клетки, няколко проучвания съобщават, че прекомерната доза bFGF инхибира тяхната пролиферация и че ефикасността му не зависи от дозата 20,21. Следователно, нашите резултати показват, че само EBHG индуцира достатъчно количество bFGF, за да инхибира прогресията на експерименталния AAA и това вероятно е причината за липсата на допълнителен ефект след прилагане на bFGF.
Терапевтичната стойност на желатинов хидрогел с включен bFGF е широко проучена по експериментален начин, свързана с ангиогенезата 22, както и регенерацията на костите или кожата 15,23, като е започнала някои клинични приложения 24. За да се използва лечението с EBHG при човешки AAA, са необходими методологични подобрения, които позволяват прилагането му по по-малко инвазивен начин, като минилапаротомия или чрез лапароскопски техники. Тъй като в момента е трудно да се изолира цялата коремна аорта и да се увие с EBHG при хора, в това проучване поставихме EBHG над коремната аорта, без да я обвиваме. Всъщност поставянето на EBHG над аортата предизвика достатъчен ефект. Следователно, това проучване предполага, че е достатъчно да се приложи EBHG върху антеролатералната страна на аортата като лечение на AAA. Освен това, желатиновият хидрогел може да бъде под формата на микросфери 24,25 и може да се инжектира около AAA. Ако може да се използва минимално инвазивен метод, това лечение може да се приложи при малки AAA или при пациенти с аневризмална патология, които са изложени на висок риск от операция.
В обобщение, нашето проучване ясно демонстрира терапевтичните ефекти на EBHG върху прогресията на експерименталната AAA. Лечението с EBHG индуцира производството на ендогенен bFGF, което увеличава CML и фибробластите, което ще запази разграждането на еластичните влакна. Подобрението, наблюдавано в хистологичните резултати, доведе до инхибиране на прогресията на експерименталния AAA. Нашите резултати предполагат потенциално клинично приложение на биоразградим EBHG за лечение на човешки AAA с помощта на минимално инвазивен метод.
Благодарим на д-р Shojiro Matsuda, Gunze Limited Research and Development Center, за доставката на EBHG и Kaken Pharmaceutical за доставката на bFGF. Тази работа е подкрепена с грант за научни изследвания (JSPS-18591402) от Японското общество за насърчаване на науката.