Субекти
Обобщение
Главен
Глиобластомите (GBM) са най-честата форма на първични мозъчни тумори, които могат да засегнат възрастни пациенти на всяка възраст. Тези силно васкуларизирани и инфилтриращи тумори са устойчиви на съвременните терапевтични терапии и най-често водят до фатален изход за по-малко от 18 месеца. Текущото лечение с лъчева терапия и използването на темозоломид осигуряват по-добри резултати за пациенти с метилиран профил на гена MGMT. 16, 17 Въпреки това, ефикасността на това лечение, дори с използването на антиангиогенни молекули (бевацизумаб), е ограничена и този тумор остава нелечим. Агресивното поведение на GBM, включително резистентност към текущи лечения и туморни рецидиви, се дължи на наличието на GBM-подобни прогениторни клетки (GSC). 18, 19 Следователно, трябва да бъдат спешно разработени нови методи за лечение, които конкретно са насочени към GBM-подобни стволови клетки, за да се унищожат тези нелечими тумори.
Използвайки подход за профилиране на микроРНК в колекция от първични култури, получени от пациент на глиомоподобни клетки (GSC), показахме, че клъстерът miR-302-367 ангажира CMS в необратимо диференцирано състояние и блокира способността им да инициират и прогресират тумори in vivo. 20 В настоящото проучване ние показваме, че GSC, получен от пациент, проектиран да стабилно и конститутивно експресира клъстера miR-302-367, е успял да освободи екзозоми, съдържащи miR-302-367. Тези екзозоми бяха бързо интернализирани от съседния GSC, което доведе до промяна на свойствата на пролиферацията и пролиферацията по зависим от miR-302-367 начин. Ортотопичният ксенотрансплантат на клетки, експресиращи miR-302-367, заедно с GSC ефективно променя развитието на тумора в мозъка на мишки, демонстрирайки терапевтичния си потенциал за блокиране на туморни рецидиви. Нашето проучване предполага, че клетъчната терапия може да бъде иновативно решение срещу рак.
Резултати
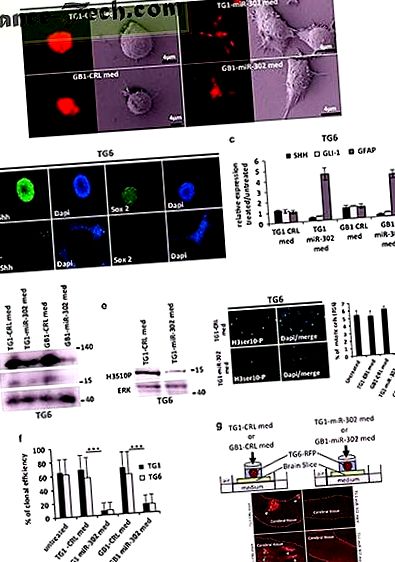
GSC, експресиращ групата miR-302, потиска експресията, пролиферацията и инфилтрацията на SHH и SOX2 по паракринен начин
Изображение в пълен размер
Клетките TG1-miR-302 и GB1-miR-302 секретират екзозоми, способни да потискат потенцията и пролиферацията на GSC
За да се идентифицират молекулите, отговорни за антитуморния ефект, беше извършена ултрафилтрация въз основа на размера на кондиционираната среда. Отбелязваме, че фракция с високо молекулно тегло (
Изображение в пълен размер
Таблица в пълен размер
Клъстерът miR-302 се пренася в съседни клетки чрез екзозомна секреция
Изображение в пълен размер
Таблица в пълен размер
Експресията на miR-302 групата в GSC насърчава паракринния супресорен ефект на тумора in vivo
Резултатите от този подход, който получихме при мишки, са принципно доказателство, че клетъчната терапия за лечение на рак заслужава да бъде разгледана. В допълнение към GSC, други екзозомосекретиращи клетки, като макрофаги, могат да бъдат изолирани от пациенти и генетично модифицирани, за да експресират стабилно терапевтични РНК молекули за лечение на тумори.
Трансплантацията на тези клетки директно на мястото на тумора по време на операцията би позволила продължително приложение на екзозоми на супресор на тумора на местно ниво, избягвайки тежки и стресиращи периодични инжекции на екзозоми в пациента.
В заключение вярваме, че нашето проучване ще предизвика интерес към използването на клетъчна терапия за in situ доставка на терапевтични екзозоми за насочване на човешки GBM.
материали и методи
Електронен микроскоп
Динамично разсейване на светлината (DLS)
Измерването на DLS беше извършено със Zetasizer Nano-ZS (Malvern Instruments, Malvern, UK). Пробите се разреждат в 100 μl 1 × PBS. Извършени са 3 × 12 серии измервания, използвайки стандартните настройки (индекс на пречупване = 1,33, температура = 25 ° C, вискозитет = 0,8882 и диелектрична константа = 79,0). Резултатите са начертани с помощта на OriginPro 2015.
Екстракция на микровезикули.
10 6/ml GSC в определена среда без микровезикули (NS34 + среда, Fareh et al.). След 72 часа GSCs бяха отстранени чрез центрофугиране (276 xg, 4 ° С, в продължение на 5 минути) и кондиционираната среда беше събрана, филтрирана през 0.2 μm филтър (Millipore, Fontenay sous Bois, Франция) и концентрирана. като се използва 100 kDa Amicon Ultra центробежен филтър (Millipore,). Концентрираната кондиционирана среда се използва за пречистване на микровезикулите чрез ултрацентрифугиране при 200 000 х g за 110 минути.
Реактиви и антитела.
Реагентите за клетъчна култура, включително DMEM, F12, глутамин, хепес, натриев бикарбонат, N2, G5 и B27, комплект за клониране на pENTR, LR клоназа II, обратна транскриптаза Superscript II, DiIC16 (3), DiO16 (3) и TRIzol са закупени реактиви от Life Technologies (Cergy Pontolse, Франция). Феталният телешки серум (FCS) е закупен от Hyclone (Brebières, Франция), а комплектът Exoquick е закупен от Ozyme (St. Quentin в Yvelines, Франция). Hoechst 33342 и Actinomycin D са доставени от Sigma (St. Quentin Fallavier, Франция), а Micromount Mounting Media е закупен от Leica Biosystems (Nanterre, Франция). Комплектът за микроРНК Taqman за обратна транскрипция, Universal Taqman PCR Master Mix и сондите Taqman са закупени от Applied Biosystems (Villebon sur Yvette, Франция). Подобрен реагент за откриване на хемилуминесценция е закупен от Bio-Rad (Marnes la Coquette, Франция).
Антителата, използвани в това проучване, са изброени тук: Поликлонални кози анти-Shh (1/50 °, sc1194, Santa Cruz Biotechnology, Santa Cruz, Германия); Мишка моноклонален анти-CXCR4 (1/50, MAB 172, R&D Systems, UK); Анти-Н3-фосфо-S10 поликлонален заек (1/100 °; ab5176, Abcam, Париж, Франция); Поликлонален заек Anti-sox 2 (1/100 °; Sox-2 (H65), sc-20088, Santa Cruz Biotechnology, Inc); Моноклонален анти-нестин на мишка (1/100 °, ab22035, Abcam); Анти-коза Alexa 488 (1/500 °; Дюселдорф, Германия); Анти заек Alexa 488 (1/500 °, Дюселдорф, Германия); Анти-мишка Alexa 488 (1/500 °, Дюселдорф, Германия); Анти-коза Alexa 546 (1/500 °, Дюселдорф, Германия); Анти заек Alexa 546 (1/500 °, Дюселдорф, Германия); Анти-мишка Alexa 546 (1/500 °; Дюселдорф, Германия); Анти-GFAP (1/200 °, 2203PGF, EUROPROXIMA, Арнхем, Холандия). Анти-PTGFRN (1/500 °, ab174180, abcam); Anti-CD81 (1/500 °, клон # 454720, R&D системи, Abingdon).
Комбинацията от сонда miRCURY LNA Knockdown, насочена към miR-302a, miR-302b, miR-302c и miR-302d, е закупена от EXIQON (Мадрид, Испания). Като контрола се използва кодирана последователност.
Клетъчна култура
Първичните клетъчни линии на GSC TG1, TG6 и GB1 са изолирани от човешки GBM, както е описано другаде. 20, 33, 34 Когато се поддържат като самообновяващи се GSC, невросферите се култивират в среда NS34 +, съдържаща EGF и bFGF (съотношение 1/1 DMEM-F12, 10 mM глутамин, 10 mM хепес, 0 натриев бикарбонат, 025%, N2, G5 и B27). Средата за клетъчна диференциация (MFCS) се състои от DMEM-F12, 10 mM глутамин, 10 mM Hepes, 0,025% натриев бикарбонат и 0,5% FCS. При експерименти с диференциация невросферите бяха дисоциирани и 500 000 отделни клетки бяха култивирани в MFCS.
Конструкции на стабилни плазмиди и клетъчни линии.
Пулът miR-302 беше амплифициран от геномна човешка ДНК чрез PCR (праймер: 5′-GGCTGAAGTCCCTGCCTTTTACCC-3 ', обратен праймер: 5′-TGGCTTAACAATCCATCACCATTGC-3') и клониран в търговски вектор pENTR (жива технология). Субклонирането в лентивирусен вектор бластицидин 2K7 (2K7BSD) се извършва чрез рекомбинация в присъствието на LR клоназа II. Използвана е произволна форма на shLuc (2K7BSD-shLuc-scb), която предотвратява инхибирането на луциферазния ген като нерелевантна конструкция (CRL). Лентивирусни частици са получени чрез трансфекция на 293 Т клетъчната линия с 2K7BSD-Cluster mir-302 или 2K7BSD-shLuc-scb конструкции заедно с векторите за опаковане (Invitrogen, Waltham, USA). След лентивирусна инфекция, клетъчни линии, които стабилно експресират miR-302 групата (TG1 miR-302 група и GB1 miR-302 група) или shLuc-scb контролата (TG1-CRL и GB1-CRL) бяха избрани в среда, съдържаща бластицидин (1 μg/ml) за 15 дни. Две стабилни клетъчни линии са разработени от независими вирусни продукции/инфекции и показват подобно поведение. Клетки, стабилно експресиращи RFP, са получени след заразяване на GSCs с 2K7BSD-RFP лентивирусни частици.
Имунофлуоресценция
Клетките се отглеждат на покрити с поли-L-лизин стъклени покривни стъкла в NBE, MFCS или кондиционирана среда. В посочените моменти от време клетките се фиксират с метанол за 10 минути при -20 ° С и се измиват с PBS, предварително охладен два пъти. Блокирането и хибридизацията на антитела се извършват в PBS, съдържащ 10% FCS и 0,1% Triton х 100. След 1 час инкубация с първичните антитела при стайна температура, клетките се промиват три пъти с PBS и те се оцветяват за 30 минути при стайна температура с видове . Специфични вторични антитела, свързани с флуорофор. В същото време ядрата се оцветяват с Hoechst 33342 (1 μg/ml). Слайдовете бяха измити два пъти с PBS, веднъж с дестилирана вода и накрая монтирани с разтвор за монтиране на гел. Имунофлуоресцентните и пропускащите светлинни изображения са направени с микроскоп Nikon eclipse Ti (Nikon, Champigny sur Marne, Франция).
Клоногенен анализ
Невросферите се дисоциират 20 пъти чрез внимателно пипетиране нагоре и надолу, за да се получат отделни клетки. Като цяло, 10 клетки бяха засяти във всяка ямка от 96-ямкови плаки, съдържащи контролна среда или кондициониран miR-302. След 21 дни инкубация се изследва всяка ямка и се брои броят на неутросферите. Експериментите бяха повторени три независими пъти.
Количествена RT-PCR в реално време
РНК се екстрахира с използване на реагент Trizol. Нивата на експресия на MicroRNA и mRNA бяха количествено определени чрез двустепенна RT-PCR в реално време. Етапите на обратната транскрипция бяха извършени с Superscript II обратна транскриптаза и микроРНК комплект за обратна транскрипция Taqman за mRNA и miRNA, съответно, следвайки инструкциите на производителя. PCR експериментите в реално време бяха проведени с помощта на универсалния Taqman PCR master mix. Експресията на малки нуклеоларни РНК SNORD54 (или U54) и GAPDH бяха използвани като вътрешен контрол за нормализиране на генната експресия. Промените в гънките се изчисляват според контролните условия, използвайки метода ΔΔCT.
Ортотопични ксенографти
2.10 5 Контролни TG1 клетки, стабилно експресиращи луцифераза (TG1-luc), бяха ресуспендирани в 5 μl разтвор на балансирана сол на Hanks (Invitrogen) и едностранно имплантирани в стриатума на мъжкия NOD.CB17-Prkdcscid/NCrHsd (Harlan, Франция). Експресиращите луцифераза клетки се инжектират съвместно с TG1 клетки, стабилно експресиращи кодираната последователност на miR-302 групата (TG1-scrb) или стабилно експресиращи miR-302 групата. Активността на луциферазата дава възможност да се наблюдава развитието на тумори при живи животни. Клетъчната преживяемост и туморният растеж се наблюдават и определят количествено при живи животни до 120 дни чрез откриване на луциферазна активност със системата IVIS Lumina II (Caliper Life Sciences, Hopkinton, MA, USA).
Органотипна култура MBS
Мозъците се дисектират от новородени мишки, вградени в 4% цереброспинален течен агар (124 mM NaCl, 3 mM KCl, 26 mM NaHCO3, 2 mM CaCl2, 1 mM MgSO4, 25 mM KH 2 PO, 25 mM KH 2 PO 4, 10 mM глюкоза) и се нарязва на филийки с дебелина 400 mm с помощта на вибратом. Резените бяха поставени в културална плоча на Millicell-CM (0.4 μm), поставени и държани в условия на интерфейс въздух-течност за повече от 3 седмици.
Парафин
Мишки с мозъчни предметни стъкла се фиксират с 4% параформалдехид в продължение на 20 минути при стайна температура, след което се промиват с PBS. Впоследствие пробите бяха дехидратирани със следната последователност от инкубации: 70% етанол 15 минути, два пъти; етанол 90% 15 минути; 95% етанол 15 минути; 100% етанол 5 минути, три пъти; Етикет 5 мин.
Ex vivo тест за туморогенеза
Десет невросфери от клетки TG1-CRL и TG1-miR-302, стабилно експресиращи RFP, бяха засяти върху горната повърхност на MBS и култивирани при интерфейс въздух-течност в продължение на 3 седмици. Клетките се третират с кондиционирана среда на всеки 48 h. Клетъчната инфилтрация и растеж бяха визуализирани в тънките секции чрез проследяване на RFP сигнала с помощта на микроскоп Nikon Eclipse Ti.
- Наднорменото тегло води до промени в кърмата, които засягат растежа на бебетата
- Болница Сан Рафаел Озоно Блогове за измами, фентъзи или терапия
- Значението на храната за растежа на децата - Mothers Today
- Значението на храненето в растежа и развитието на децата - БРЕМЕННОСТ
- Лечение на болки във врата с терапия Su Jok