- Субекти
- Обобщение
- Въведение
- Резултати
- Mer е невярно изразено в AML
- Mer активира клетъчното оцеляване и антиапоптотичните пътища
- Инхибиране на Mer с нокдаун на Mer shRNA
- Инхибирането на Mer с помощта на shRNA намалява фосфорилирането на p38, ERK и CREB
- Инхибирането на Mer предизвиква миелобластна апоптоза инвитро
- Мер инхибирането намалява миелобластната пролиферация инвитро
- Повторното въвеждане на Mer спасява способността на миелобластите да избягват апоптозата и да образуват колонии
- Мер инхибирането увеличава преживяемостта без левкемия in vivo
- Дискусия
- Допълнителна информация
- Файлове с изображения
- Допълнителна фигура S1
- Word документи
- Допълнителна таблица S1
- Допълнителна таблица S2
- Допълнителна таблица S3
- Допълнителни фигури и таблици Легенди
Субекти
- AML
- Онкогенни протеини
- Онкогенеза
- Отстраняване на грешки в тази статия е публикувано на 5 септември 2016 г.
Обобщение
Последните изследвания в AML разкриха само няколко отклонени експресирани или мутирали протеинкинази, които служат като потенциални терапевтични цели. Високото съотношение на алелите на мутацията на дублиране на FLT-3 в тандем е свързано с лоша прогноза и са разработени инхибитори на малки молекули, насочени към клетки, експресиращи FLT-3. 6,7 Положителен AML C-Kit, открит при голям брой рецидивиращи пациенти, е свързан с лоша прогноза и е насочен и към инхибитори на малки молекули. 8,9 Необходими са по-целенасочени терапевтични възможности, за да се осигури по-ефективно лечение на AML или да се позволи намаляване на високоинтензивната химиотерапия.
В този ръкопис съобщаваме, че Мер е аберативно свръхекспресиран в повечето проби от педиатрични и възрастни пациенти с ОМЛ, в сравнение с нормалните миелоидни предшественици. Mer също се изразява в по-голямата част от AML клетъчни линии. Активирането на Mer в AML клетъчни линии води до сигнализиране за оцеляване и пролиферация, включително фосфорилиране на ERK1/2 и AKT, както и p38 MAPK (p38), MSK1, CREB, ATF1 и STAT6. И накрая, ние показваме, че инхибирането на Mer чрез РНК интерференция в човешки AML клетъчни линии води до значително увеличаване на апоптозата, намален потенциал за образуване на колонии и забавяне на развитието на левкемия при имунокомпрометирани мишки. Терапевтичното насочване на аберрантна експресия на Mer в AML е атрактивно, потенциално позволяващо по-добри резултати при високорискови пациенти, комбинирана терапия с намалена интензивност при пациенти с нисък риск или терапевтична възможност за тези, които не могат да понасят високорисковата химиотерапия.
Резултати
Mer е невярно изразено в AML
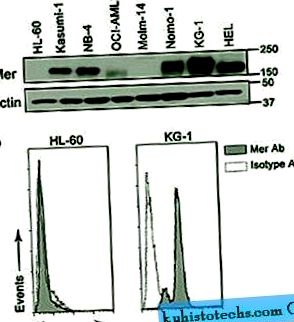
За да оценим експресията на Mer в AML, ние оценихме 14 различни миелоидни клетъчни линии. Mer е открит чрез имуноблотинг в повечето от клетъчните линии, анализирани като 150-180 kD протеин (варирането на размера се дължи на диференциално гликозилиране 18). Проточен цитометричен анализ потвърди констатациите; клетките, които бяха положителни за Mer, демонстрираха по-висока интензивност на флуоресценция в сравнение с клетките, оцветени с контрола на изотипа на миши имуноглобулин G1, докато клетките отрицателни не (Фигура 1 и допълнителна таблица S1). Нашият анализ разкри висока степен на корелация между резултатите от имуноблот и поточна цитометрия и показа, че има известна степен на експресия на Mer в 86% (12 от 14) от AML клетъчните линии. В този анализ на клетъчната линия експресията на Mer не е свързана с класификация на френско-американско-британски (FAB) или Световната здравна организация (СЗО), цитогенетична аномалия, възраст на пациента, от която е получена клетъчната линия, нито е свързана с Други известни клинични характеристики (допълнителна таблица S1).
Mer се изразява в AML клетъчни линии. ( да се ) Цели клетъчни лизати, получени от AML клетъчни линии, бяха подложени на имуноблот анализ с анти-Mer антитяло. Това представително петно показва откриването на протеина Mer (150-180 kD) в няколко AML клетъчни линии. Актинът беше открит като контрола на натоварването. ( б ) Експресията на Mer на клетъчната повърхност се определя чрез поточна цитометрия след оцветяване с първично анти-човешко антитяло Mer и PE-конюгирано вторично антитяло (сива хистограма). Неспецифичното оцветяване се определя с използване на IgG1 изотипно контролно първично антитяло и PE-конюгирано вторично антитяло (бяла хистограма). Показани са представителни Mer отрицателни (HL-60) и Mer положителни (KG-1) клетъчни линии.
Изображение в пълен размер
Mer се изразява в повечето диагностични проби от костен мозък, получени от пациенти с ОМЛ, но не и в нормален костен мозък. Миелобластите, събрани при диагностицирането на пациенти с ОМЛ, се анализират чрез поточна цитометрия за експресията на Mer. ( да се ) Клетки, експресиращи човешки CD33 и CD45 се анализират след оцветяване с миши анти-човешко антитяло Mer и PE-конюгирано вторично антитяло за експресия на Mer (сива хистограма). Неспецифичното оцветяване се определя с използване на антитяло за контролиране на изотип на IgG1 на мишка и PE-конюгирано вторично антитяло (бяла хистограма). Представени са представителни профили на поточна цитометрия за Mer-положителни (> 20% положителни клетки), Mer-dim (10-20% положителни клетки) и Mer-отрицателни (
Изображение в пълен размер
Инхибиране на Mer с нокдаун на Mer shRNA
За да проучим функционалната роля на Mer в AML, ние въведохме РНК с къса фигура (shRNA), насочена срещу Mer, в двете клетъчни линии, използвани по-горе. Nomo-1 и Kasumi-1 са трансдуцирани с лентивируси, кодиращи една от двете различни shRNA конструкции (shMer1 и shMer4), за да намалят експресията на Mer, или е разработена не заглушаваща shRNA (shControl) и са разработени стабилни клонинги. Извършен е имуноблот анализ на лизати на цели клетки, за да се оцени ефикасността на инхибирането на Mer. И двата клониращи делеции ефективно намаляват експресията на Mer, като клонингът shMer4 от всяка клетъчна линия има малко по-ефективен клирънс Mer от клонинга shMer1 (Фигура 4а). Тези констатации бяха потвърдени от поточен цитометричен анализ за експресия на Mer на клетъчната повърхност, който демонстрира ефективен клирънс и за двете конструкции, с малко повече инхибиране в shMer4 клетките (70–80% спад), отколкото shMer1 (60% спад) в сравнение с shControl (Фигура 4b)
Експресията на протеина Mer се намалява чрез експресията на shRNA в AML клетъчни линии. Клетките Kasumi-1 и Nomo-1 са заразени с лентивирусни частици, съдържащи конструкции с къса фиксирана RNA (shRNA), насочена към Mer (shMer1, shMer4) или GFP като не-заглушаващ контрол (shControl). Премахването на Mer беше потвърдено от ( да се ) имуноблот анализ на целоклетъчни лизати и ( б ) поточна цитометрия с използване на анти-Mer антитяло. Стойностите представляват средни стойности и са получени от три независими експеримента. ( ° С ) Родителските и shRNA-съдържащи клетки Kasumi-1 и Nomo-1 бяха инкубирани в безсерумна среда в продължение на 2-3 часа, последвано от 10-минутна обработка с 200 nM rhGas6 ((+) Gas6) или буфер (мъртъв глад от серума) . Целоклетъчните лизати се подлагат на имуноблот анализ с антитела, специфични за фосфорилираните и общите протеини, анализирани на Фигура 3д. От тях p38, ERK1/2 и CREB последователно демонстрират намаляване на фосфорилирането, съответстващо на нивото на Mer, когато се стимулират с Gas6.
Изображение в пълен размер
Инхибирането на Mer с помощта на shRNA намалява фосфорилирането на p38, ERK и CREB
За да оценим кои последващи пътища са най-засегнати от инхибирането на Mer, използвайки shRNA, ние допълнително анализирахме протеини, които демонстрираха повишено фосфорилиране след стимулация на Gas6 (т.е. MSK1, p38, ERK, AKT, CREB, ATF1 и STAT6), използвайки нашите Merckdown Nomo-1 и Kasumi -1 клетъчни линии. Когато серумните гладни клетки бяха стимулирани с Gas6, клетъчните линии за разрушаване последователно демонстрираха съпътстващо намаляване на фосфорилирането на p38, ERK и CREB, в сравнение с тези, третирани само с буфер (Фигура 4в).
Инхибирането на Mer предизвиква миелобластна апоптоза in vitro
Фенотипните ефекти на инхибирането на Mer върху AML бяха оценени in vitro. Клетките Nomo-1 и Kasumi-1 със или без shRNA конструкциите се оцветяват с йо-Pro-1 йодид и пропидиев йодид след 18 часа глад в серума и се подлагат на поточен цитометричен анализ. Клетките, които взеха само йод-про-1 йодид (ранна апоптоза) и тези, които взеха йо-про-1 йодид и пропидиум йодид (късна апоптоза и некроза) бяха включени в анализа; Клетките, приемащи само пропидиев йодид (мъртви клетки), бяха изключени, за да се елиминира възможността за анализ на клетки, които са умрели преди анализа. Клетъчните линии с намалени нива на Mer показват по-висока степен на апоптоза; ∼ 35% (shMer1) и 55% (shMer4) от клетките се считат за апоптотични в отговор на серумен глад. Това е значително по-голямо от 15-20% апоптоза, наблюдавана в контролните клетъчни линии (P
Merckdown придава податливост на апоптоза. ( да се ) Родителски, не заглушаващ контрол shRNA (shControl) и Merckdown (shMer1, shMer4) Клетките Kasumi-1 и Nomo-1 бяха серум гладувани или култивирани в пълна среда в продължение на 18 часа преди оцветяване с пропидиев йодид и I-Pro-1 йодид. Апоптотичните клетки бяха идентифицирани чрез поточна цитометрия. Показани са представителни профили на поточната цитометрия. Показани са процентите на ранните апоптотични клетки (долен десен квадрант; Yo-Pro +/PI−) и късна апоптоза/некроза (горен десен квадрант; Yo-Pro +/PI +). ( б ) Кумулативните данни показват значително натрупване на апоптотични клетки в клетки Kasumi-1 и Nomo-1, когато Mer се инхибира от shRNA (* P
Премахването на Mer намалява потенциала за образуване на AML колония. Родителски, безшумен контролен shRNA (shControl) и Merckdown (shMer1, shMer4) Nomo-1 и Kasumi-1 клетки се култивират в метилцелулоза в продължение на 13 дни. ( да се ) Показани са представителни плакови изображения на клетъчната линия Nomo-1. ( byd ) Общият брой на колониите се определя чрез демонстриране на статистически значимо намаляване на образуването на колонии, когато Mer (* * P
Инхибирането на експресията на Mer удължава оцеляването при миши модел на AML. NOD-SCID-гама мишки бяха облъчени с 200 cGy и трансплантирани с пет милиона родителски NRNA-1 (родителски, n = 8), ненасочена shRNA (shControl, n = 8) или Merckdown (shMer1 n = 16, shMer4 n = 14 ) клетки чрез интравенозно инжектиране. Анализът на Каплан-Майер, сравняващ оцеляването, показва статистически значимо удължаване (Р 20
Механизмът на свръхекспресията на Mer при AML е неясен; Възможните механизми включват адаптации на транскрипционно или транслационно ниво, като променено метилиране на промотор или регулация на микроРНК. Установено е, че повишената експресия на Axl, друг член от семейството на тирозин киназата Tyro-3/Axl/Mer, в миелоидна левкемия след химиотерапевтично лечение съвпада с повишено метилиране на промотора на Axl. 21 При рак на гърдата заглушаването на супресорната микроРНК на Mer е свързано с повишени метастази. 22 Ненормалната експресия на Mer при левкемия все още не е свързана със специфични епигенетични промени и е необходима по-нататъшна оценка на механизма на свръхекспресия на Mer при AML.
Тези резултати също така предполагат, че AML клетъчните линии разчитат на сигнализирането на Mer, за да поддържат жизнеспособността при стрес и in vivo. Освен това тези данни демонстрират обосновка за насочена анти-Mer терапия както при AML при възрастни, така и при деца. Потенциално, инхибирането на Mer може да има клинично значим ефект при пациенти в двата края на възрастовия спектър на AML, като монотерапия или в комбинация със съвременни терапии с AML.
В момента има няколко транслационни агенти, насочени към Mer в предклинично развитие. Едно от тях е наскоро описаното моноклонално антитяло Mer, което показва намалена туморна миграция и оцеляване в мултиформените клетъчни линии на глиобластома. 32 В ранното развитие има и селективни инхибитори на тирозин киназа Mer с малка молекула, които ефективно намаляват фосфорилирането на Mer in vitro и in vivo. 33
Нашите данни предоставят доказателство за концепцията, че Mer е терапевтична цел при AML и вероятно ще доведе до по-нататъшно развитие на Mer насочени агенти, включително допълнителни антитела и/или специфични инхибитори на малки молекули. Тези нови терапии имат потенциал да повлияят на пациенти с ОМЛ, както и на пациенти с други злокачествени заболявания, характеризиращи се с зависимост от Mer, и могат да осигурят средство за подобряване на преживяемостта с намалена токсичност спрямо настоящите стандартни химиотерапевтични режими.
- Причината, поради която авокадото допринася за загуба на тегло
- Причината, поради която авокадото допринася за отслабването Salud La Revista El Universo
- Самоконтролът помага за поддържане на теглото
- DPP-4 инхибитори срещу; Лого на GLP-1 рецепторите след неуспех на монотерапията
- Липсата на сън променя метаболизма и допринася за наддаване на тегло El Diario Vasco