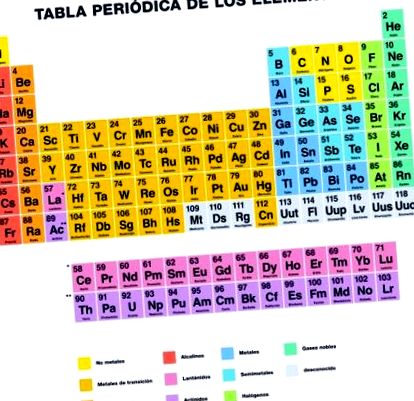
Каква е периодичната таблица на елементите?
Периодичната таблица или периодичната таблица на елементите е a организиран запис на химични елементи според неговия атомен номер, свойства и характеристики.
Състои се от 118 елемента, потвърдени от Международния съюз за чиста и приложна химия (IUPAC, за неговото съкращение на английски език), от които
- 94 са елементи, които съществуват в природата, и
- 24 елемента са синтетични, тоест те са създадени изкуствено.
Развитието му е тясно свързано с откриването на нови елементи и изучаването на техните общи свойства. Аспекти като понятието атомна маса и връзките между атомната маса и периодичните свойства на елементите са от основно значение за конфигуриране на съвременната периодична таблица.
Периодичната таблица работи като основен инструмент за изучаване на химията, тъй като позволява да се идентифицират по последователен и лесен начин разликите и приликите между химичните елементи.
Създаването му се приписва на руския учен Димитри Менделеев през 1869 г. Оттогава периодичната система е подобрена и актуализирана от други учени, тъй като се откриват и изучават нови елементи.
Как е организирана периодичната таблица?
Периодичната таблица представя всички известни досега елементи, които са организирани и разположени според техните характеристики и взаимовръзка между тях в група, периоди, блокове и метали, металоиди и неметали.
Групи
Периодичната таблица се състои от 18 групи елементи, организирани във вертикални колони, номерирани от 1 до 18 отляво надясно, започвайки с алкалните метали и завършвайки с благородните газове.
Елементите, които принадлежат към една и съща колона, имат сходни химични характеристики въз основа на това как са структурирани електроните в последния слой на атома.
Например първата колона съдържа елементите, които имат електрон в последната обвивка на атома. В този случай калият има четири обвивки, а в последната има електрон.
Химическите елементи са организирани в групи, както следва:
- Група 1 (I A): алкални метали.
- Група 2 (II А): алкалоземни метали.
- Група 3 (III Б): семейство скандий.
- Група 4 (IV B): титаново семейство.
- Група 5 (V B): семейство ванадий.
- Група 6 (VI B): хромово семейство.
- Група 7 (VII B): манганово семейство.
- Група 8 (VIII B): семейство желязо.
- Група 9 (VIII B): семейство кобалтови.
- Група 10 (VIII B): семейство никел.
- Група 11 (I B): медно семейство.
- Група 12 (II Б): семейство цинк.
- Група 13 (III А): земни.
- Група 14 (IV A): карбониди.
- Група 15 (V A): нитрогеноиди.
- Група 16 (VI A): халкогени или амфигени.
- Група 17 (VII A): халогени.
- Група 18 (VIII A): благородни газове.
Периоди
Периодите са седемте хоризонтални реда, които периодичната таблица има. В тези редове елементите, които имат броя на електронните обвивки, които съвпадат с броя на периода.
Например, в първия ред водородът и хелийът имат обвивка от електрони. Във втори период има осем елемента, които имат две обвивки на електрони. В третия ред елементите имат три обвивки от електрони и т.н.
В период шест са елементите, които имат шест електронни обвивки, както и долният ред на лантанидите. В период седем са елементите, които имат седем електронни обвивки, както и последният ред актиниди.
Метали, металоиди и неметали
Три категории елементи, съставляващи периодичната система, могат да бъдат разграничени от техните химични и физични свойства, а именно: метали, металоиди и неметали.
- Метали: те са твърди елементи при стайна температура, минус живака, който е в течно състояние. Те са пластични и пластични и са добри проводници на топлина и електричество. Те се намират от лявата страна на масата.
- Без метали: Те са предимно газове, въпреки че има и течности. Тези елементи не са добри проводници на електричество. Те са от дясната страна на масата.
- Металоиди или полуметали: те имат свойства както на метали, така и на неметали. Те могат да бъдат лъскави, непрозрачни и не много пластични. Електрическата му проводимост е по-ниска от металите, но по-висока от неметалите. Те се намират в дясната страна на масата, между метали и неметали.
Блокове
Периодичната таблица също може да бъде разделена на четири блока въз основа на последователността на електронните обвивки на всеки елемент. Името на всеки блок произлиза според орбиталата, в която се намира последният електрон.
- Блок s: групи 1 и 2 от алкални метали, алкалоземни метали, водород и хелий.
- Блок p: обхваща групи 13 до 18 и металоиди.
- Блок г: съставен от групи 3 до 12 и преходни метали.
- Блок f: няма номер на група и съответства на лантаниди и актиноиди. Те обикновено се поставят под периодичната таблица.
Тенденции в периодичната таблица
Периодичните тенденции се отнасят до основните физични и химични свойства, които елементите притежават и които позволяват тяхната организация в периодичната таблица. Тези тенденции са свързани с промените, които се случват в атомната структура на всеки елемент според периода или групата, към която принадлежи.
Сред периодичните тенденции са:
Основни данни за химичните елементи
Периодичните таблици обикновено съдържат основни данни за всеки един от съществуващите елементи в него, което позволява да се създаде последователна организация въз основа на нейните характеристики като символ, име, атомен номер и атомна маса, за да се определи неговото използване.
- Атомна маса: се отнася до масата на атома, съставен от протони и неутрони.
- Йонизационна енергия: е енергията, необходима за отделяне на електрон от атома.
- Химичен символ: съкращения за идентифициране на химичния елемент.
- Име: Името, дадено на химичния елемент, може да бъде получено от латински, английски, френски, немски или руски.
- Електронна конфигурация: как електроните са структурирани или организирани в атом.
- Атомно число: се отнася до общия брой протони, които един атом има.
- Електроотрицателност: е способността на атома да привлича електрони към себе си.
- Окислителни състояния: индикатор за степента на окисление на атом, който е част от съставен химичен елемент.
За какво служи периодичната таблица?
Периодичната таблица е много полезна за научни изследвания предвид различните функции, които има.
- Тя позволява да се идентифицират разликите и приликите между различните елементи. Например, той съдържа ценна информация като атомната маса на всеки елемент.
- Това дава възможност да се анализира химичното поведение на елементите. Например при разграничаване на електроотрицателността и електронната конфигурация на елемента.
- Той служи като основен инструмент за изучаване на химията, включително биологията и други клонове на науката, тъй като идентифицира основните характеристики на химичните елементи.
- Улеснява различаването на елементите от атомния им номер. Това е така, защото елементите са съставени от атоми, които получават името си и се диференцират по броя на протоните, електроните и неутроните, които той съдържа.
- Може да се използва за прогнозиране на химичните свойства на новите елементи, които ще бъдат включени в таблицата, като се вземат предвид характеристиките на вече дефинираните елементи.
История на периодичната таблица
Създаването на периодичната таблица се приписва на руския учен Дмитрий Менделеев, който през 1869 г. събра в таблица 63-те елемента, известни досега на науката.
Менделеев организира елементите все по-често от техните атомни маси, като се грижи да постави тези, чиито физически свойства са подобни в една и съща колона. Той дори остави празни пространства, очаквайки съществуването на други елементи, които все още не са открити по това време и това трябва да бъде включено в таблицата.
Скоро след това германският химик Юлиус Лотар Майер подрежда елементите въз основа на физическите свойства на атомите. И накрая, сегашната си структура се дължи на швейцарския учен Алфред Вернер.
Последните големи промени в периодичната таблица са работата на носителя на Нобелова награда за химия Глен Сиборг, който, наред с други неща, поръча серията актиниди под серията лантанид.
- Телездраве Какво е това, как да се подготвим, се покрива от Националния институт за стареене
- Как да разбера дали кучето ми е с идеалното си тегло
- Вашето смути ви прави дебели. Ние знаем как да го избегнем
- Сурими, от какво е направен, как е направен и какво допринася за тялото?
- Какви минерали се губят в потта и как да ги заменим Supradyn®, витаминен комплекс