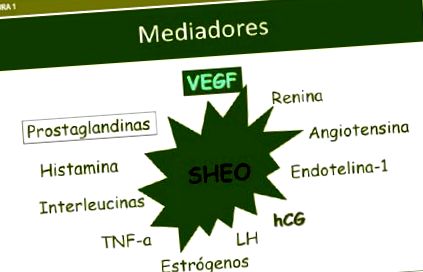
Синдромът на хиперстимулация на яйчниците е ятрогенно усложнение на леченията за стимулиране на яйчниците. Етиологията му е неизвестна, но се появява само в присъствието на hCG, което причинява отделянето на вазоактивни вещества: интерлевкини, IGf-1, активиране на системата ренин-ангиотензин-алдостерон, простагландини и VEGF, който изглежда е основният медиатор . Прегледани са аспектите на патофизиологията на синдрома, стратегиите за неговата профилактика и настоящите насоки за лечение.
Синдромът на хиперстимулация на яйчниците (OHHS) е ятрогенно усложнение на индукцията на овулация. Етиологията е неизвестна. Задействащият фактор на синдрома е hCG, който причинява производството на ангиогенни вещества: интерлевкини, IGF-1, ренин-ангиотензинова система и VEGF, основният медиатор. Преразглеждат се физиопатология, превенция и стратегии за лечение на OHHS.
ВЪВЕДЕНИЕ
Синдромът на хиперстимулация на яйчниците (OHSS) е ятрогенно усложнение на леченията за стимулиране на яйчниците. Честотата на синдрома варира между 3-6% от IVF циклите при умерени форми и 0,5-2% при тежки случаи. Етиологията на заболяването е неизвестна, но е известно, че синдромът се появява само в присъствието на HCG. Въпреки че не е причинителният фактор, той е спусъкът за медиаторите, участващи в патофизиологията.
ПАТОФИЗИОЛОГИЯ
OHSS се развива след приложение на HCG, което причинява освобождаването от яйчниците на вазоактивни вещества, които действат като медиатори: интерлевкини I и VI, IGF-1, системата ренин-ангиотензин-алдостерон, особено ангиотензин II, простагендини и медиатори на възпалението, но VEGF е определен като основен медиатор. Тези фактори водят до увеличаване на съдовата пропускливост с изтичане на вода и протеини от вътресъдовото пространство към третото пространство, намалявайки перфузията на бъбреците, сърцето или мозъка. Естрадиолът е повишен, но няма пряк вазоактивен ефект (Фигура 1).
Вазоактивните вещества, освободени от яйчника в присъствието на hCG, водят до увеличаване на съдовата пропускливост с изтичането на вода и протеини от вътресъдовото пространство към третото пространство. Това причинява изчерпване на вътресъдовия обем, отговорен за симптомите на синдрома: хипотония, олигурия, асцит, повишен вискозитет на кръвта, хипонатриемия и хиперкалиемия. Тази хиповолемия е свързана с хемоконцентрация, понижено централно венозно налягане, артериална хипотония и тахикардия.
Намалената бъбречна перфузия води до повишена реабсорбция на натрий и вода в проксималния канал, което води до олигурия и ниска концентрация на натрий в урината (Фигура 2).
Генерирането на нови съдове е от съществено значение за репродуктивния цикъл и ролята на растежните фактори, участващи в регулирането на този процес, особено VEGF, е демонстрирана от промените в тяхната експресия през целия цикъл. Интрафоликуларните нива на VEGF, особено VEGF-A, се повишават по време на фоликуларната фаза, с пик в началото на лутеалната фаза. Последваща съдова регресия по време на атрезия на фоликулите се произвежда от повишени нива на инхибиторите на ангиогенезата и намалени нива на VEGF в края на лутеалната фаза (Фигура 3).
Гранулозните клетки, теките на развиващия се фоликул и стероидогенните клетки на жълтото тяло произвеждат и реагират на ангиогенни фактори и вазоактивни пептиди. Неоваскуларизацията, която настъпва след овулация, по време на ранните етапи на развитие на жълтото тяло, е сравнена с бързата ангиогенеза, наблюдавана при растежа на тумора.
В стимулираните цикли експресията на VEGF и неговия рецептор 2 се увеличава в отговор на hCG, а при OHSS максималните нива съвпадат с максималното нарастване на съдовата пропускливост.
Прилагането на hCG предизвиква свръхекспресия на VEGF на ниво яйчници, вероятно поради генетично предразположение. След свързването на VEGF с VEGFR2 настъпва активиране на рецептора, което води до повишена съдова пропускливост, която причинява синдрома. Тъй като първата стъпка на активиране на VEGFR2 включва рецепторно фосфорилиране, може да се мисли, че прилагането на каберголин ще блокира VEGFR2 фосфорилирането и по този начин ензимната каскада, която води до увеличаване на съдовата пропускливост, характеризираща синдрома. Този блок не засяга VEGF рецептора 2, от който зависи лутеалната ангиогенеза. Тоест, той частично инхибира фосфорилирането на VEGF-R2 (1). В действителност се съобщава, че 0,25 mg дневно в продължение на 8 дни от деня на приложението на HCG намаляват честотата на OHSS с NNT 9. В Cochrane преглед намалява риска от умерен, но не тежък OHSS.
Добавянето на hCG в култура на ендотелни клетки е в състояние да ги накара да секретират VEGF, да увеличи присъствието на рецептори VEGF-рецептор 2 и да повиши пропускливостта на капилярите, демонстрирано чрез наблюдение на разделянето на еднослойни клетки при оцветяване на актиновите нишки и наблюдение с конфокална микроскопия. Най-интересното при тези проучвания беше, че с помощта на анти-VEGF антитяло този ефект на hCG върху ендотела беше обърнат. Използването на селективен инхибитор на VEGF-2 рецептора инхибира in vivo увеличаването на пропускливостта на капилярите при пациенти с рак: вече има клинични проучвания фаза III, които демонстрират това.
Ангиотензин II (Ang II) е добре известен със своята роля в контрола на ангиогенезата на системно ниво. В допълнение, Ang II действа върху съдовия контрол на ниво яйчници, при формирането на жълтото тяло и лутеолизата. Ang I се произвежда от предшественика, ангиотензиноген, чрез ензимната активност на ренин, който се намира в гранулозата, теката и лутеалните клетки. Клетките на микроваскуларния ендотел имат ангиотензин конвертиращия ензим и са способни да преобразуват Ang I в Ang II (Фигура 4).
Наличните данни сочат, че Ang II може да играе роля в развитието на първоначалното жълто тяло. Доказано е, че Ang II стимулира нивата на иРНК за bFGF в лутеалните клетки и увеличава пролиферацията на аортни ендотелни клетки в говеда. Освен това, комбинацията от естрадиол и VEGF или bFGF увеличава производството на Ang II в лутеалните ендотелни клетки. Системата ренин-ангиотензин е активна по време на началната лутеална фаза и участват ендотелни клетки (2) .
КЛАСИФИКАЦИЯ
Съществуват различни класификации на синдрома на хиперстимулация на яйчниците, една от тях е тази, модифицирана от Navot през 1996 г. (Фигури 5 и 6) от тази, определена от Голан, която прави разлика между тежка и критична хиперстимулация (3) .
I степен - Лек. Характеризира се с двустранно уголемяване на яйчниците до 5x5 cm с множество фоликули и жълти тела. Естрадиолът е по-голям от 1500 pg/mL (6000 pmol/L)
Степен II - Умерен. Яйчниците са по-големи, до 12 см, а пациентът има коремна болка или дискомфорт и стомашно-чревни симптоми (гадене, повръщане и диария). Внезапното наддаване на тегло с повече от 3 кг може да бъде ранен признак на умерен СОХС.
III степен - Тежка. Яйчници по-големи от 12 см, ацит и бъбречна дисфункция. Счита се за критично, когато се наблюдават плеврален и/или перикарден излив, електролитни нарушения (хипонатриемия, хиперкалиемия), хиповолемия и хиповолемичен шок. Отбелязана хемоконцентрация, повишен вискозитет на кръвта, тромбоемболични явления, включително дисеминирана вътресъдова коагулация в най-тежките случаи.
Регресията е спонтанна и настъпва 10-14 дни след началото, но ако настъпи бременност, отнема повече време за разрешаване.
ПРЕВЕНЦИОННИ СТРАТЕГИИ
Най-доброто лечение е първичната профилактика: не прилагайте hCG (4). Те могат да се разглеждат на 3 нива:
1. По време на стимулация
да се. Ниска доза стимулация на гонадотропин и внимателно проследяване
б. Коустинг. Въпреки че досега е доказано, че е ефективен в ретроспективни и наблюдателни проучвания, няма достатъчно доказателства, които да препоръчват използването на брегови полета в рутинната практика (Cochrane 2011 показва, че няма доказателства за полза). Коустингът е поставен под въпрос поради възможния ефект върху броя и качеството на ооцитите, по-ниска възприемчивост на ендометриума спрямо спада на естрадиола и нива на бременност, по-ниски от тези, установени при обичайните IVF процедури.
° С. Хипофизен блок с антагонисти вместо агонисти. Намалява честотата, но не я премахва
д. In vitro съзряване на ооцитите. Неефективна стратегия по отношение на репродуктивните резултати
2. При индукция на овулация
да се. Отменете цикъла и не прилагайте hCG. Това е единствената ефективна стратегия сама по себе си
б. Намалете дозата на hCG наполовина
° С. Задействайте овулацията с болус от GnRH агонисти. Възможно само когато антагонисти са били използвани за блокада на хипофизата
д. Предполага се, че интравенозно приложение на албумин или хидроксиетил нишесте по време на пункцията може да се използва като превантивна мярка при жени с висок риск. Точният начин на действие на албумина е неизвестен, но се смята, че той блокира вазоактивните вещества, участващи в патогенезата на OHSS, а от друга страна, повишава вътресъдовото онкотично налягане, като по този начин предотвратява загубата на вода от вътресъдовия отдел. Има множество изследвания с противоречиви резултати. Cochrane 2011 показа, че няма доказателства за полза.
и. Прилагайте каберголин 1 седмица от hCG. При доза от 0,25 mg/ден, честотата на ранните леки или умерени OHSS намалява, но не е тежка или късна OHSS. Не е ефективно, ако настъпи бременност
3. Избягвайте ендогенни и екзогенни hCG
да се. Не прилагайте hCG в лутеалната фаза
б. Не извършвайте превода. Витрифициране на ооцити или ембриони. Ако hCG не е прилаган, елиминира риска от СОХС.
Mancini et al. през 2011 г. те направиха мета-анализ на 5 проучвания, които изследваха 286 цикъла с антагонисти срещу 303 с агонисти и стигнаха до заключението, че при пациенти със синдром на микрополикистозните яйчници (PCOS) антагонистичният протокол намалява честотата на OHSS (5). Pundir J et al през 2012 г. стигат до същото заключение (6) .
В допълнение, днес знаем, че цикълът, стартиран с антагонисти, позволява заместването на узряването на ооцитите с HCG с болус на GnRH агонисти и това напълно избягва синдрома (ако в този цикъл няма бременност), както е предложено от Griesinger през 2011 г. (7 ). Humaidan P обяснява как, въпреки че индуцирането на узряването на яйцеклетките с α-GnRH е добра алтернатива за избягване на OHSS, лутеалната фаза е недостатъчна и е свързана с ниски нива на имплантиране
Криоконсервацията на ембриони е метод за превенция на OHSS, който се опитва да избегне бременността като източник на ендогенен HCG. García-Velasco през 2012 г. (8) и Humadian през 2014 г. (9) предлагат криоконсервация на всички ембриони при пациенти с високи пикове на естрадиол и показват криотрансфер в следващи цикли с физиологични нива на естрадиол. Това също подобрява перинаталните усложнения като прееклампсия или забавен вътрематочен растеж (IUGR). Тази стратегия избягва появата на SHEO
Въпреки че употребата на бромокриптин и каберголин не е свързана с повишена тератогенност, по-добре е да се ограничи излагането на ембриона на тези лекарства, когато е възможно. Тератогенезата от което и да е лекарство или причина обикновено се проявява през първия триместър на бременността. Първият триместър съвпада с периода на минимален растеж на макроаденом при бременната жена, която е спряла лечението. Поради това се препоръчва отнемане на бромокриптин или каберголин, когато се пропусне първата менструация и се получи положителен тест за бременност. Особено каберголинът има много дълго действие и стойностите на PRL могат да бъдат потиснати до 120 дни след оттеглянето му.
Репродуктивните проучвания при зайци не показват тератогенни или ембриотоксични ефекти. Тъй като обаче няма контролирани проучвания при бременни жени, каберголин не трябва да се използва по време на бременност, освен ако не е абсолютно необходимо (10).
ЛЕЧЕНИЕ
OHSS е самоограничен процес и при липса на бременност пациентът се нормализира с началото на менструацията. В случай на бременност симптомите могат да продължат няколко седмици. Лечението трябва да бъде симптоматично и консервативно, като възстановява интраваскуларния обем с прилагането на кристалоиди и/или албумин, като се избягват възможните усложнения, които могат да се появят. Медицинското лечение обикновено е достатъчно за повечето пациенти, запазвайки хирургично лечение за катастрофални усложнения: усукване на яйчниците или неограничено кървене. Пациентите с тежки симптоми може да се нуждаят от интензивно лечение.
Балансът на течностите трябва да се следи внимателно с правилна регистрация на входовете и изходите, теглото и коремната обиколка трябва да се измерват ежедневно, както и хематокритът. Ако пациентът е хемодинамично нестабилен, трябва да се постави централен венозен катетър за налягане.
Като цяло, през първия час трябва да се дадат 1-2 L изотонични течности за бързо възстановяване на тъканната перфузия. Ако се прилагат повече течности, трябва да се следи централното венозно налягане или белодробното капилярно налягане. Попълването на течности трябва да продължи, докато сърдечното налягане и системното кръвно налягане са ниски. Плазмените разширители като декстран, човешки албумин или плазма трябва да бъдат допълнени с подходящи електролити, ако е необходимо. Ефектът от лечението може да се увеличи чрез добавяне на орален индометацин, който блокира синтеза на простагландини и намалява капилярната пропускливост. Хематокритът трябва да се наблюдава и разширителите да се прекратят, когато хематокритът падне под 38%.
Диуретиците не се препоръчват, тъй като течностите от трети пространство не се влияят от него. Освен това повечето диуретици действат в дисталния канал, с минимален ефект в проксималния канал. Индуцираната от лекарства диуреза може да намали вътресъдовия обем и може да не е в състояние да изчисти асцит или хидроторакс. Бъбречната недостатъчност може да реагира на допамин (0,18 mg/kg час). Пероралният докарпамин може да бъде опция при пациенти със СОХС, които се нуждаят от допамин.
Опасността от висцерално нараняване от сляпа парацентеза се намалява чрез ултразвуково насочване. Парацентезата води до бързо подобряване на бъбречната функция (поради повишено венозно връщане), осмоларност и хемоконцентрация, както и облекчаване на диспнея и дискомфорт в корема. Плевралният излив трябва да се дренира, за да се облекчи диспнеята. Парацентезата може да бъде полезна и за облекчаване на затрудненото дишане при пациенти с асцит и хидроторакс.
Трябва да се има предвид профилактична антикоагулация с хепарин или LMWH и компресионни чорапи, за да се сведе до минимум рискът от венозна тромбоза. Лечението на венозни усложнения е антикоагулация с хепарин.
След няколко дни течността от третото пространство отново навлиза във вътресъдовото пространство, хемоконцентрацията се обръща и отделянето на урина се нормализира. Пациентът се подобрява симптоматично и приемът на орална течност се възобновява. Интравенозните течности трябва да бъдат намалени, тъй като пероралният прием се увеличава. Пероралният прием трябва да бъде ограничен до 1-2 L, за да се улесни диурезата и да се поддържа обемът на кръвта. Пълното разрешаване обикновено отнема 10-14 дни от появата на симптомите (Фигура 8).
Пациентите с тежка OHSS имат рестриктивна екстрапаренхимна белодробна дисфункция поради натрупване на интраабдоминална или плеврална течност, която ограничава спускането на диафрагмата и разширяването на белите дробове. Това води до некоординирана вентилация и ателектаза, с нарушения на вентилацията и перфузията и хипоксемия.
Клиничните прояви включват диспнея, тахипнея, умерена хипоксемия, повишена алвеоларно-артериална разлика в кислорода, хипокарбия, дихателна алкалоза и метаболитно завършване.
Тромбоемболичните усложнения са най-редките, макар и най-сериозните от всички случаи на СОХС. Публикувани са тромбоемболични усложнения на вътрешните югуларни, субклавиални, аксиларни и мезентериални съдове. Те могат да причинят трайно неврологично увреждане или смърт. Те се дължат на хемоконцентрация и хиперкоагулация и повечето от тях са следствие от високи нива на естрогени
Пациентите с генетична тромбофилия (дефицит на антитромбин III, мутация на F. V, недостатъци на протеини С или S, са по-предразположени към развитие на тромбоемболични явления в рискови ситуации, поради което някои центрове извършват скрининг за тромбофилии преди започване на овариална стимулация.
В обобщение, тежкият синдром на хиперстимулация на яйчниците в повечето случаи е предвидима, предотвратима и избягваема патология. Въпреки всичко, никоя стратегия не е напълно ефективна. В случаите, в които се задейства, управлението трябва да бъде симптоматично и често мултидисциплинарно, като се грижи за коригирането на дисфункцията в хидравличния баланс и предотвратяването на усложненията му, с възможно най-малко инвазивни мерки и винаги като се има предвид възможността на бременността, стига да е извършен ембриотрансфер.
- Сесия 2 Общ синдром (астения, анемия, загуба на тегло) с остеопения и смачкване
- Vitex agnus-castus е едно от най-добрите лечения за s; Предменструален синдром (ПМС) - Ферма
- Терапия; влияния на s; сънна апнея и синдром на хипопнея; o Интегрална медицина
- Земетресение разтърси Коста Рика - La Prensa
- С; ndrome; Информационен център за генетични и редки болести на задника на мозъка и бъбреците (GARD) - програма NCATS