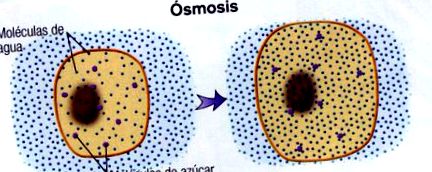
Осмозата е много важен процес както на химическо, така и на биологично ниво.
Но, Какво е осмоза? Осмозата е феномен, при който преминаването или дифузията на разтворител става през полупропусклива мембрана, която позволява преминаването на разтворителя, но не и на разтвореното вещество, от по-разреден разтвор към по-концентриран.
Способността на водата да преминава през плазмената мембрана, която се държи като полупропусклива мембрана, зависи от разликата в концентрацията между извънклетъчните и вътреклетъчните течности и се определя от наличието на минерални соли и разтворени органични молекули.
Водните среди, разделени от полупропускливи мембрани, могат да имат различни концентрации и се наричат:
- Хипертонична, тези с висока концентрация на разтворени вещества в сравнение с други, в които концентрацията е по-ниска.
- Хипотонична, тези, които съдържат ниска концентрация на разтворени вещества в сравнение с други, които я имат по-висока.
Водните молекули се дифузират от хипотоничната към хипертоничната среда, което води до увеличаване на налягането върху лицето на мембраната на хипотоничния компартмент, т.нар. осмотичното налягане. Като следствие от осмотичния процес може да се постигне равновесие, концентрациите да бъдат изравнени и тогава средата ще бъде изотоничен, тоест имат еднаква концентрация.
Осмоза в кухнята
Не сме наясно, но можем да видим осмозата в нашата кухня: когато варим тестени изделия или ориз, когато приготвяме набръчкани картофи, когато накисваме листа от маруля или бобови растения
Ако поставим сух лист маруля във вода, той възстановява цялата си текстура за няколко часа. Марулята беше загубила водата си и я възвръща благодарение на осмозата.
Един много прост експеримент за демонстриране на този факт може да се извърши с две пилешки яйца, оцет и два разтвора: един силно концентриран в някакво разтворено вещество (например сол) и друг само с дестилирана вода.
Както можем да видим в експеримента, яйцето, което е в много концентриран разтвор на сол (хипертонична), има тенденция да изхвърля водата, ставайки по-сбръчкана, докато когато е в дестилирана вода (хипотоничен разтвор), тя се надува. Същият експеримент може да се извърши чрез тестване на различни концентрирани разтвори с разтворени вещества, по-големи от солта и наблюдение на ефекта по по-драстичен начин (например с глюкозен сироп или захар).
Хидростатичното налягане, което водата упражнява за влизане или излизане, се нарича осмотично налягане и се регулира от концентрациите и температурата.
Какво би се случило с нашите клетки?
В следващите видеоклипове можете да видите червените кръвни клетки в хипертоничен разтвор и в хипотоничен разтвор. Когато червените кръвни клетки са в хипертоничен разтвор, за изравняване на концентрацията те освобождават вода, оставайки "суха", което причинява смъртта им.
Когато разтварянето е хипотонично, червените кръвни клетки са склонни да поемат вода и да се подуват, понякога причинявайки руптура на клетките или лизис.
Следващите изображения показват резултата от следното изживяване:
Червените кръвни клетки от едно и също лице бяха въведени в три различни разтвора:
- Изотоничен. Еритроцитите се отлагат в контейнер, съдържащ кръвен серум.
- Хипотонична Еритроцитите се въвеждат в контейнер, съдържащ кръвна плазма, разредена с вода.
- Хипертонична Еритроцитите се поставят в контейнер, съдържащ кръвна плазма, към който е добавен концентриран разтвор на NaCl.