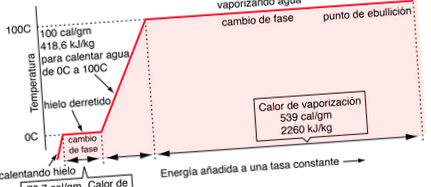
Преходите между твърда, течна и газообразна фаза обикновено включват големи количества енергия в сравнение със специфичната топлина. Ако към маса лед, ние добавяме топлина с постоянна скорост, за да я прекараме през фазовите промени, първо към течността и след това към парите, енергиите, необходими за извършване на фазовите промени (наречена латентна топлина на синтез и латентна топлина на изпаряване), би довело до платата, които наблюдаваме в графика температура/време по-долу. Налягането в графиката се приема за 1 стандартна атмосфера.
| Температурни скали | Промени във водната фаза | Точка на кипене |
| Вода |
Данните за промяната на фазата на изпаряване се вземат при налягане от 1 стандартна атмосфера.
При изучаването на енергията на фазовите промени във водата откриваме, че потенциалната енергия се третира като отрицателно количество. Аналогията с механична система, която има гравитационна потенциална енергия и кинетична енергия, може да ни помогне да разберем логиката на това количество отрицателна енергия. Винаги сме свободни да избираме нулата на потенциалната енергия и изглежда логично да изберем тази нула от потенциална енергия, така че свободната молекула в покой да има нулева енергия. Свързана частица в покой има отрицателна потенциална енергия.
| Промени във водната фаза |
Известно е, че трябва да добавим 100 калории енергия, за да повишим температурата на 1 грам вода от 0 ° до 100 ° С. Част от тази енергия увеличава кинетичната енергия на молекулите, а друга част се добавя към потенциалната енергия.
Размерите на блоковете, които представляват кинетичната енергия на молекулите при 0 ° C и при 100 ° C, ни предоставят визуална илюстрация на значението на температурата и естеството на абсолютната или температурната скала на Келвин. От дефиницията за кинетична температура се вижда, че размерът на блока е пропорционален на температурата, а съотношението на височините на блоковете EC (кинетична енергия) е съотношението на температурите. Но кинетичната температура по своята същност е абсолютна температура, така че съотношението на височините на блоковете е 373K/273K. Следователно абсолютната температура всъщност е пропорционална на кинетичната енергия на транслация на молекулите, докато температурите на Целзий са избрани за удобство.
В процеса на нагряване на водата от 0 ° до 100 ° С. се добавят 100 калории енергия. Част от тази енергия увеличава кинетичната енергия на молекулите, а друга добавя към потенциалната енергия. За да се оцени количеството, добавено към кинетичната енергия, молекулните скорости при двете температури трябва да бъдат оценени с помощта на разпределението на скоростта на Болцман.
Нетната печалба в кинетичната енергия, когато водата се нагрява от 0 ° до 100 ° С., тогава е 16,7 калории/грам. Останалата част от енергията ще отслаби привлекателната сила между водните молекули. Това отслабване на междумолекулните сили се проявява в намаляването на повърхностното напрежение на горещата вода.
В процеса на изпаряване на водата трябва да се добави голямо количество енергия, за да се преодолеят останалите кохезионни сили между молекулите. Допълнителна част от тази енергия се превръща в работа на PdV за разширяване на газа от неговия много малък обем течност до обема на получената пара.
Ако топлината на изпаряване на вода при 100 ° C е 539 калории, тогава, като се извади работният компонент от 41 калории, предполага, че действителната консумация на свързваща енергия на водните молекули при 100 ° C е 539-41 = 498 калории.
Защо, топлината на изпаряване е по-висока в човешкото тяло?
Интересна особеност на процеса на охлаждане на човешкото тяло чрез изпаряване е, че топлината, извлечена чрез изпаряване на един грам пот от човешката кожа при телесна температура (37 ° С), се цитира в книгите по физиология като 580 калории/, вместо номиналните 540 калории/g. при нормална точка на кипене. Въпросът е, защо е по-висока от телесната температура.
Основната част от отговора е, че енергията на свързване на водните молекули е по-висока при тази по-ниска температура и следователно се нуждае от повече енергия, за да ги отдели и да ги доведе до газообразно състояние. Промяната в топлината на изпаряване може да бъде изчислена повече или по-малко, като се използва това, което знаем за водата (специфична топлина на водата, 1 калория/gm ° C). За нагряване на грам вода от 0 ° C до 37 ° C са необходими 37 калории, но промяната в кинетичната енергия е много по-малка от:
По-рано е показано, че когато водата се нагрява от нула до 100 ° C, кинетичната енергия на водните молекули се увеличава само с 61,7 - 45 = 16,7 калории/г., но ние знаем, че са необходими 100 калории за затопляне. Следователно приносът за отслабването на водните връзки е 83,3 кал/g. Използвайки резултата от вода при 37 ° С, очевидно е, че трябва да се доставят 52,4 калории допълнителна енергия, за да се изпари водата при 37 ° С.
Има допълнителен елемент при моделирането на топлината на изпаряване при телесна температура - необходимата работа на PdV за довеждането на водата до газообразно състояние е малко по-малка от 37 ° C. По аналогия с изчислението на работата по-горе, беше установено, че тази работа е 34,2 калории/g, 6,8 калории/g по-малко, отколкото при 100 ° C.
Така че този модел предполага топлина на изпаряване при 37 ° C.:
Топлина на изпаряване при телесна температура = 539 cal/gm + 52,4 cal/gm - 6,8 cal/gm = 585 cal/gm.
Така че този прост модел е доста добър според цитираните 580 кал.
- Natrol, Carb Intercept с фаза 2 Carb Controller, 1,000 mg, 60 Veggie Caps - iHerb
- Класическо почистване на лицето - Център за красота Nina Merli
- Личен треньор за отслабване в Доностия Сан Себастибн
- Madero се оттегля от събитието на PAN със стриптизьорки
- Лични тренировки с фитнес и спортно хранене - Orthos
- От януари 2018 г. сумите, освободени от данък върху доходите на физическите лица за ваучери за храна и стипендии за
- Как да изберем добър пуешки колбас Alimmenta, диетолози-диетолози
- Лазерно лечение на гъбички по ноктите - ДИНАН КЛИНИК
- Това трябва да е вашата диета за увеличаване на мускулната маса с натурални храни
- Това са калориите, които можете да изгорите, правейки домакинска работа
- Препоръчително напрежение на батерията - YELLOWTOP®, REDTOP®, BLUETOP® OPTIMA® Държач на батерията
- Обучителни ленти за окачване
- Печено пържено мляко (лека рецепта) - бисквитки на Cuky’s
- Тесни дрехи сериозните здравословни проблеми, причинени от тази мода - Кордоба - COPE
- Ефекти от менструалния цикъл върху състава на тялото, енергията и здравните новини от