Rev Méd Чили 2007; 135: 631-635
КЛИНИЧНИ СЛУЧАИ
Синдром на дефицит на глюкозен транспортер тип 1 (SDGLUT-1), лекуван с кетогенна диета. Клиничен случай
Тип транспониране на глюкоза 7 синдром на дефицит (GLUT-1 SD), лекуван с кетогенна диета. Доклад за един случай
Verónica Cornejo E 1a, Juan Francisco Cabello A 1, Marta Colombo C 2, Erna Raimann B 1 .
1 Лаборатория по метаболитни заболявания, Институт по хранене и хранителни технологии (INTA), Университет на Чили, 2 Лаборатория по метаболитни заболявания, болница Ван Бурен, Валпараисо.
диетолог, магистър по човешко хранене
(Ключови думи: Мозъчни заболявания, метаболитни, вродени; Транспортер на глюкоза тип 1; Припадъци)
И През 1991 г. De Vivo описва синдрома на дефицит на церебралния транспортер на глюкоза тип 1 (SDGLUT-1) (OMIM 606777) при двама пациенти, които представят епилептична енцефалопатия, която еволюира със забавено психомоторно развитие, спиране на черепния растеж, микроцефалия, некоординация и спастичност . В допълнение, той установи, че има намаляване на нивото на глюкоза и лактат в цереброспиналната течност (CSF), но не откри хипогликемия 1 .
SDGLUT-1 има автозомно доминиращо наследство 2. Транспортерът Glut-1 е гликопротеин, съставен от 492 аминокиселини, отговорен за транспортирането на глюкоза през кръвно-мозъчната бариера, която се експресира в съдови ендотелни клетки, астроцити и неврони. Генът е кодиран на късото рамо на хромозома 1 (p34.2) и е съставен от 10 екзона и 9 интрона. Към днешна дата са описани повече от 30 мутации. Доказано е, че концентрациите на Glutl и Glut3 са ниски при раждането и се нормализират при отбиване, период, съответстващ на по-голям растеж и съзряване. Някои автори показват, че този гликопротеин се инхибира от фенобарбитал 3 .
Предперинаталната и перинаталната анамнеза на дете, засегнато от тази патология, очевидно е нормална до 2-месечна възраст, когато се появяват епизоди на апнея и движения на очите от тип opsoclonus, които могат да предшестват епилептични припадъци. Детските припадъци са клинично фрагментирани, ЕЕГ показва мултифокални разряди и са описани генерализирани тонични типове, миоклонус, атипично отсъствие, атонични и некласифицирани. Честотата може да бъде ежедневна, случайна или без припадъци 4. Тези припадъци не реагират на антиконвулсанти. Неепилептични пароксизмални събития като интермитентна атаксия, умствено объркване, летаргия, сънливост, хемипареза, необичайни движения, парализа, нарушения на съня, микроцефалия или забавяне на растежа на черепа 5. .
При лабораторни тестове се наблюдава персистираща хипогликония (под 40 mg/dl), лактатът в CSF може или не може да бъде намален (6 .
Лечението се основава на кетогенна диета, която ще осигури необходимата енергия на мозъка чрез кетонни тела. Поради голямото ограничение на естествените храни, богати на въглехидрати, които от своя страна са източник на основни хранителни вещества, диетата трябва да бъде постоянно допълнена с минерали, липо и водоразтворими витамини, L-карнитин и липоева киселина, според възрастта и пола 7-10 .
Описваме клиниката, биохимията, молекулярното изследване и дългосрочното проследяване на първия случай на SDGLUT-1, диагностициран в Чили.
КЛИНИЧЕН СЛУЧАЙ
Пациентка, родители, които не са роднини, без релевантна перинатална анамнеза; тегло при раждане 3-450 g, височина 49,5 cm и обиколка на черепа 35,2 cm. Apgar 9, на 5 минути.
На възраст от месец и половина той представи генерализирани тонични клонични припадъци с продължителност секунди, развиващи се с 20 миоклонуса на ден, добавяйки флексийни спазми. Тя е получила фармакологично лечение с валпроева киселина, фенобарбитал и карбамазепин, без клиничен отговор, предизвиквайки нежелана реакция към валпроевата киселина със симптоматична хиперамонемия.
На възраст от 3 месеца и половина бяха проведени тестове за изключване на метаболитно заболяване, като се установи лактацидемия от 26,5 mg/dl (VN: 5-15), намаляване на CSF лактата с 5,6 mg/dl (VN: 10,8 -18,9 mg/dl). Пирувиновата киселина в плазмата е повишена (1,4 mg/dl) (VN: 0,3-0,9), но при CSF е нормална (0,43 mg/dl) (VN: 0,5-1,7) и амонякът е 85 µg/dl (35-100 µg/dl). Количественото определяне на аминокиселините в серума, ацилкарините в пълната кръв, органичните киселини в урината и карнитина в серума бяха нормални.
На 5 месеца електроенцефалограмата (ЕЕГ) открива непрекъсната полиморфна тета-делта активност, считана за ненормална за възрастта, и ядрено-магнитен резонанс показва фронтална атрофия с увеличаване на субарахноидалните пространства. Той еволюира със забавяне на психомоторното развитие и забавяне на черепния растеж, атаксия на багажника и двустранен пирамидален синдром.
На 7 месеца той е приет в детската болница в Бостън, Съединените американски щати, където е установено намаляване на глюкозата в ликвора с 26 mg/dl и нормогликемия (84 mg/dl), като се получава съотношение между двата параметъра 0, 31 (нормална стойност над 0,65 + 0,01), съобразена с хипогликорахия, предполагаща SDGLUT-1.
Доказано е, че протеинът Glut-1 в еритроцита е идентичен с протеина Glut-1 на ендотелните клетки на мозъчните капиляри, както по отношение на имунната, така и по химичната реакция. Поради тази причина транспортът на глюкоза в еритроцитите е сравним с транспорта на глюкоза през кръвно-мозъчната бариера. Предвид тази констатация е разработена 3-O-метил D глюкозната техника, която определя усвояването на глюкозата от еритроцитите, което позволява екстраполация с транспорта на глюкоза в кръвно-мозъчната бариера 11. В нашия случай беше приложена тази техника, като се получи усвояване на глюкоза от 44% (VN 80% -100%), потвърждавайки SDGLUT-1.
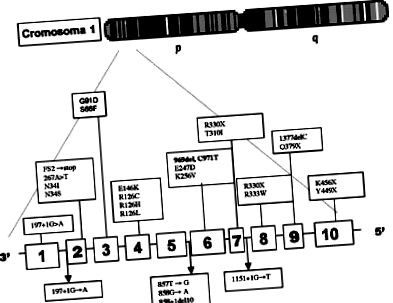
При молекулярното изследване бяха използвани полимеразна верижна реакция (PCR) и анализ на полиморфизми на рестрикционни фрагменти (RFLP) 3,6, определящи мутацията на делеционната група 969, C971T, разположена в екзон 6, на Glut-гена. 1 (Фигура 1) (Молекулярно проучване, проведено от д-р Д. Де Виво).
Компютърната томография с единична фотонна емисия (SPECT) показа двустранен времеви, ляв париетален и таламичен хипометаболизъм.
Кетогенната диета започна незабавно, осигурявайки 90 калории на килограм тегло, с 85% липиди, 9% протеини и 6% въглехидрати, със съотношение 3: 1 между липиди и протеини плюс въглехидрати, въз основа на протокола, използван в INTA, от Чилийският университет 9,10. Диетата забранява храни със захароза, сорбитол, фруктоза и лактоза, консумацията е ограничена, поради което е необходимо да се добавят калций (450 mg/ден), цинк (5 mg/ден), витамини, особено витамин С (1 g/ден) за предотвратяване на клетъчно окисляване, L-карнитин (50 mg/kg/ден) и липоева киселина (200 mg/ден).
След 7 дни от започване на кетогенната диета припадъците изчезнаха и заедно започнаха намаляването на антиконвулсантите.
В момента на 6 години той поддържа кетогенната диета с 83% липиди (27% от тях съответстват на средноверижни триглицериди) и 17% протеини плюс въглехидрати (съотношение 2,5: 1). Хранителните добавки са същите като в началото и те са адаптирани според възрастта и хранителния статус.
Гликемията остава при стойности от 80 до 90 mg/dl, общ холестерол при 187 mg/dl, HDL при 55 mg/dl и LDL при 121 mg/dl. Калциурията, креатининурията, биохимичният профил, венозните газове и плазмените електролити са в нормални граници. Бета хидроксибутиратната киселина на гладно е 2,5 µM/1, а след хранене 5,0 µM/L, като се има предвид кетогенезата, когато тази стойност е над 2,0 µM/1.
При неврологичното изследване хиперактивното поведение се откроява при психичното му изследване. В черепните нерви той представя дизартрия и лицева хипомимия. Моторният преглед показва намален тонус на багажника и крайниците, без компромис със силата или мускулната трофика. При малкия мозъчен преглед има фин тремор на намерението, наличие на синкинеза, дисметрия и дискретна дисдиадохокинезия. Походката е нестабилна и се характеризира с увеличаване на основата на опора, без латерализация.
Неговият коефициент на интелигентност (IQ), оценен от теста за интелигентност на Wechs-ler за деца в предучилищна възраст (WISP) 12, получава общ коефициент на интелигентност от 103 точки, горната граница на средния нормален диапазон, коригиран според северноамериканските стандарти. Представя обаче значително несъответствие между вербалната и ръчната скала, в ущърб на последната (вербален IQ: 119, висок нормален и ръчен IQ: 85, бавен нормален), което се изразява в специфични трудности при визуално-пространствената организация и визомоторния.
Хранителният статус е нормален: индекс на телесна маса от 15,8 kg/m 2 (VN между 15 и 18 kg/m 2) 13, с тегло (21 kg) за възраст и височина (1,16 m) за възрастта, и двата параметъра при 75-и персентил от референтната таблица (Национален център за здравна статистика) 14. .
От 1991 г. до днес в света са диагностицирани около 100 случая, всички чрез клинични прояви 15 .
Повечето от случаите, описани в литературата, имат нормална анамнеза преди и перинатално и първата клинична проява са гърчове през първите 4-месечна възраст, без отговор на антиконвулсантно лечение. Налице е и намаление на глюкозата и лактата в цереброспиналната течност, равно на това, което е установено в нашия случай. Диференциалната диагноза обаче е разширена и върху други клинични симптоми, тъй като е описана при деца, които са имали само необичайни движения на очите и при които първоначално е имало съмнение за окултен невробластом. Следователно се препоръчва за всяко дете със сугестивни симптоми и нормална кръвна глюкоза да се оцени стойността на глюкозата в CSF, за да се изключи GLUT-1 SDG. .
Друг важен момент е положителният отговор на кетогенната диета, която потиска гърчовете. Кетонните тела навлизат в мозъка чрез монотричния карбоксилен транспортер, използван от мастни киселини със средна верига, които се метаболизират изключително в митохондриалната матрица до ацетил-КоА, превръщайки този субстрат в единственото мозъчно гориво. В представения клиничен случай кетогенната диета е започнала на 7-месечна възраст и припадъците са спрени незабавно. Към днешна дата той поддържа тази диета и не е проявявал отново гърчове 8 .
Кетогенната диета се използва често при рефрактерна епилепсия, показвайки, че действа като естествен антиконвулсант, свързвайки този ефект с наличието на бета-хидроксибутиратна киселина. Няколко проучвания показват, че продължителната му употреба не причинява нарушения в растежа на теглото 16,19. В нашия случай кетогенната диета има съотношение между липиди и протеини плюс въглехидрати 3: 1, тя е адаптирана към хранителните изисквания според възрастта и теглото, като подчертава задоволяването на нуждите от витамини и минерали. След почти 6 години проследяване, пациентът има нормален растеж, наблюдавайки тегло и височина в 75 процентила, ХМЛ от 15,8 kg/m 2, в нормалните граници за нейната възраст.
Всички описани случаи имат известно когнитивно увреждане, което варира от обучителни затруднения до тежка умствена изостаналост. Освен това са наблюдавани езикови промени, описващи дизартрия, с промяна на експресивен и възприемчив език 1 5. Нашият случай има нормално когнитивно развитие, с общ коефициент на интелигентност 103 и вербален коефициент на интелигентност 119, като последният се класифицира във високия нормален диапазон, който което се различава от това, което се среща в литературата. Това може да се дължи на две причини: една от тях е възрастта на диагностициране, тъй като повечето от описаните пациенти са открити късно. Другото е, че някои мутации от типа отсъствие или делеция са свързани с умерена клинична форма. Предложената корелация генотип/фенотип е хипотеза, която изисква да се потвърди по-голям брой случаи. Освен това, мутацията, открита в нашия случай, не е описана в друго семейство 3,20 .
ПРЕПРАТКИ
1. De Vivo D, Trifiletti R, Jacobson R, Roñen G, Behmand R, Heik S. Дефектен транспорт на глюкоза през кръвно-мозъчния бамер като причина за постоянна хипогликорахия, гърчове и забавяне на развитието. N Engl J Med. 1991; 325: 703-9. [Връзки]
2. Wang D, Brockmann K, Korenke CG, Von Moers A, Ho YY, Pascual JM et al. Синдром на дефицит на Glut-1: автозомно предаване на доминат на мутация на R126H missense. Ан Неврол. 2001; 50: S124. [Връзки]
3. Wang D, Pascual J, Yang H, Engelstad K, Jhung S, Peng Sun R, De Vivo D. Синдром на дефицит на Glut-1: клинични, генетични и терапевтични аспекти. Ан Неврол. 2005; 57: 111-18. [Връзки]
4. Von Moers A, Brockmann K, Wang D, Korenke CG, Huppke P, De Vivo DC, Hanefeld F. ЕЕГ характеристики на синдрома на дефицит на глута-1. Епилепсия. 2002; 43: 941-5. [Връзки]
5. Pascual J, Wang D, Lecumberri B, Yang H, Mao X, Yang R, De Vivo D. Дефицит на GLUT1 и други заболявания на транспортера на глюкоза. Eur J Ендокринол. 2004; 150: 627-33. [Връзки]
6. Pascual J, Van Heerttum R, Wang D, Engelstad K, De Vivo D. Изобразяване на метаболитния отпечатък на дефицит на Glutl в мозъка. Ан Неврол. 2002; 52: 458-64. [Връзки]
7. Акоста П. Глюкозен транспортен протеинов дефект, дефицит на пиру-вате дехидрогеназен комплекс и неразрешими гърчове. В: Акоста Р, Яничели С. изд. Протоколи за поддръжка на храненето: Редакционна лаборатория Abbott, 2001; 279-95. [Връзки]
8. Klepper J, Diefenbach S, Kohlschütter A, Voit T. Ефекти от кетогенната диета при синдром на дефицит на глюкозен транспортер 1. Простаглан-дин Leukot Essent мастни киселини. 2004; 70: 321-7. [Връзки]
9. Дрян V. Кетогенна диета при лечение на рефрактерна епилепсия. Rev ChilNutr. 2000; 27: 326-31. [Връзки]
10. Дрян V. Кетогенна диета в педиатрията. В: Sanjurjo P, Baldellou A, eds. Диагностика и лечение на наследствени метаболитни заболявания: Редакционен Ergon SA, Мадрид, Испания, 2001; 111-120. [Връзки]
11. Klepper J, Garcia Alvarez M, O'Driscoll K, Parides M, Wang D, Yuan HO Y, De Vivo DC. Еритроцити 3-0. тест за усвояване на глюкоза на метил-D за диагностициране на синдром на глюкозно-транспортен протеин. J Clin Lab Anal. 1999; 13: 116-21. [Връзки]
12. Wechsler D. Ръководство за интелигентната скала на Wechsler за деца, преработено. Сан Антонио Тексас: Редакция The Psychological Corporation, Harcourt Brace Jovanovich, Inc. 1974 г. [Връзки]
13. Kuczmarski R, Ogden C, Grummer-Strawn L. CDC класации за растеж: Съединени щати. Разширени данни от жизненоважни и здравни статистики;№ 314. Хаятсвил, Мериленд: Редакционен национален център за здравна статистика 2000. [Връзки]
14. Villalobos N, Vergara A, Jara C, Orellana N, Maggi A, Torres M, González I. Амбулаторно лечение на недохранване поради дефицит и излишък при деца под 6-годишна възраст. Министерство на здравеопазването, правителство на Чили 2005: 7-14. [Връзки]
15. Гордън Н, Нютон Р. Дефицит на транспортер на глюкоза тип 1 (GLUT-1). Brain Dev.2003; 27: 477-80. [Връзки]
16. Bailey E, Pfeifer H, Thiele E. Използването на диета при лечение на епилепсия. Епилепсия и поведение. 2005; 6: 4-8. [Връзки]
17. Vamecq J, Vallée L, Lesage F, Gressens P, Stables J. Антиепилептична популярна кетогенна диета: възникващи обрати в древна история. Neurobiol Prog. 2005; 75: 1-28. [Връзки]
18. Couch S, Schwarzman F, Carroll J, Koenigsberger D, Nordli D, Deckelbaum R et al. Растеж и хранителни резултати на деца, лекувани с кетогенна диета. J Am Diet Assoc. 1999; 99: 1573-5. [Връзки]
19. Liu Y, Williams S, Basualdo-Hammond C, Stephens D, Curtis R. Проспективно проучване: растеж и хранителен статус на деца, лекувани с кетогенна диета. J Am Diet Assoc. 2003; 103: 707-12. [Връзки]
20. Wang D, Kranz-Eble P, De Vivo DC. Мутационен анализ на GLUT1 (SLC2A1) при синдром на дефицит на Glut-1. Hum mutat. 2000; 16: 224-31. [Връзки]
Благодаря
Към детската болница в Бостън, особено д-р Дарил Де Виво, който проведе молекулярното изследване на случая.
Получено на 9 май 2005 г. - Прието на 28 август 2006 г.
Кореспонденция на: Проф. Verónica Cornejo E. INTA, Университет на Чили. Кутия 13811, Сантяго, Чили. Факс: 56-2-2941254. Имейл: [email protected]
Цялото съдържание на това списание, с изключение на случаите, когато е идентифицирано, е под лиценз Creative Commons
Бернарда Морин 488, Провиденсия,
Клетка 168, поща 55
Сантяго, Чили
Тел .: (56-2) 2753 5520